
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。宝鸡因钛产业发达被称为中国钛谷,其钛产品产量占全国80%以上,占世界产量的20%以上。请回答下列问题:
(1)钛元素位于周期表中第4周期_____族,基态铁原子的价电子的电子排布式为______。
(2)钛元素在化合物中有+2、+3、+4等多种价态,试分析因显著的“压电效应“面被广泛应用于超声波发生装置中的偏钛酸钡(BaTiO3)中Ti的化合价为______。
(3)TiCl3是一种不稳定的氯化物,主要用作强还原制、烯烃聚合的催化剂以及偶氮染料分析等。
①溶波中的Ti3+易被FeCl3氧化,发生反应的离子方程式为________;若利用此反应原理,用已知标准浓度FeCl3溶液来滴定某含Ti3+的溶液时,可选用______溶液作指示剂判断滴定的终点。
②化学式为[Ti(H2O)6]Cl3的绿色晶体是TCl3的六水合物的一种晶型,该晶体中,与Ti3+T形成配位键的原子是_____(填元素符号),该原子的杂化类型为________;该晶体所含元素中,电负性最大的元素是_______(写出元素符号)。
③化学式为[Ti(H2O)5Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol绿色晶体溶于水配成500mL溶液,加入足量AgNO3使Cl-完全沉淀,消耗AgNO3的物质的量为____mol。
④写出一种与H2O互为等电子体的阳离子______(填化学式)。
(4)TiO2的熔点为1800℃,TiCl4的熔点为-25℃,同为Ti的+4价化合物,熔点相差悬殊的原因是___________。
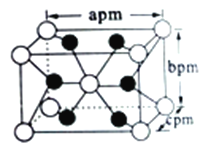
(5)自然界的钛主要以金红石( 主要成分为TiO2)的形式存在。TiO2 的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2 的摩尔质量为M g/mol,阿伏加德罗常数的值为NA,根据图中所示数据列出该晶体密度的计算式ρ=_______g·cm-3(用NA表示阿伏伽德罗常数,用含M、a、b、c的代数式表示)。
【答案】 ⅣB 3d64s2 +4 Fe3+ + Ti3+ == Fe2++ Ti4+ KSCN(或硫氰化钾) O sp3 O 2 H2F+ TiO2是原子晶体,原子间以共价键相结合,而TiCl4是分子晶体,分子以范德华力相结合,共价键作用远大于范德华力 ![]() (或
(或![]() )
)
【解析】(1)钛元素22号,位于周期表中第4周期ⅣB族,铁是26号元素,基态铁原子的价电子的电子排布式为3d64s2 。(2)由化合价代数和为0的规律,偏钛酸钡(BaTiO3)中Ti的化合价为+4价。(3)①溶波中的Ti3+易被FeCl3氧化成Ti4+,发生反应的离子方程式为Fe3+ + Ti3+ == Fe2++ Ti4+;若利用此反应原理,用已知标准浓度FeCl3溶液来滴定某含Ti3+的溶液时,多余的Fe3+ 遇到KSCN(或硫氰化钾)溶液呈血红色,可选用KSCN(或硫氰化钾)溶液作指示剂判断滴定的终点。②化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是O(填元素符号),O原子形成2个δ键和2个孤电子对,该原子的杂化类型为sp3;该晶体所含元素中,电负性最大的元素是O。③化学式为[Ti(H2O)5Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol绿色晶体溶于水配成500mL溶液,溶液中含有2mol氯离子,加入足量AgNO3使Cl-完全沉淀,消耗AgNO3的物质的量为2mol。④与H2O互为等电子体的阳离子H2F+ (填化学式)。(4)TiO2的熔点为1800℃,TiCl4的熔点为-25℃,同为Ti的+4价化合物,熔点相差悬殊的原因是TiO2是原子晶体,原子间以共价键相结合,而TiCl4是分子晶体,分子以范德华力相结合,共价键作用远大于范德华力。(5)每个晶胞中含有钛原子数为8×1/8+1=2,氧原子数为4×1/2+2=4,则晶体密度为2×Mg·mol-1÷NAmol-1÷(a×b×c)pm3=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】(1)某化工厂用氯气与石灰乳生产漂白粉,该厂出厂产品说明书如下:

①漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式:_____________________________;______________。
②某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448 mL气体,则该漂白粉中所含有效成份的质量为___________(假设漂白粉中的其它成份不与硝酸反应)。
(2)将14 g Na2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12 L,所得溶液的体积为400 mL。试计算:原混合物中Na2O的质量为___________g,所得溶液中Na+的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常用烧碱来清洗抽油烟机上的油渍(主要成分是油脂),下列说法不正确的是( )
A. 烧碱具有强腐蚀性,故清洗时必须戴防护手套
B. 热的烧碱溶液去油渍效果更好
C. 清洗时,油脂在碱性条件下发生水解反应
D. 油脂属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=12的NaOH溶液和pH=10的NaOH溶液等体积混合后溶液的
A. pH=11 B. pH=10.3
C. c(H+)=2×10-12mol/L D. c(H+)=5×10-11mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验需要0.2 mol·L-1 NaCl溶液240 mL,配制流程如下:


回答下列问题:
(1)①中称得________gNaCl。
(2)玻璃棒在②③两步中的作用分别是____________、______________。
(3)某同学在第⑧步观察液面时俯视,所配溶液浓度______(填“偏高”“偏低”或“无影响”)。
(4)容量瓶在使用之前要__________,具体操作是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上硫化碱法制备Na2S2O2的原理是2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应的△H<0),某研究小组在实验室用此法制备Na2S2O2的装置与步骤如下,请回答有关问题:
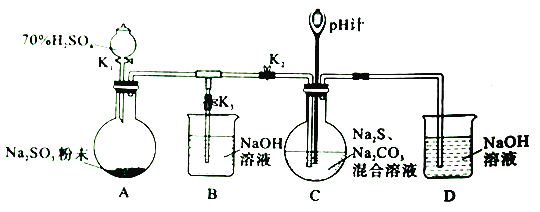
I、制备Na2S2O2实验步骤如下:
步骤1:先组装仪器,然后________。
步骤2:添加药品。关闭K1、K2、K3按图中所示依固体、溶液顺序将所需药品加入各仪器。
步骤3:打开K2,关闭K3,调节K1,使硫酸缓慢匀速滴下,导管口有气泡冒出,pH计读数逐渐减小。当pH计读数接近7时,打开K3,关闭K1、K2。
步骤4:将C中所得溶液加热浓缩,冷却析出Na2S2O2,经过滤、洗涤、干燥,得到产品。
(1)步骤1中缺少的操作是___________。
(2)装置A中发生反应的化学方程式为___________。
(3)为了使SO2尽可能被吸收完全,在不改变装置C中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可以采取的措施有________(任写一条)。
(4)装置C中Na2S和Na2CO3的物质的量浓度之比约为2:1,若Na2S过量则C中会出现淡黄色的浑浊,用离子方程式解释其原因为____________。
(5)实验制得的Na2S2O3产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论_____________。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用浓度为0.1000mol/L碘的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-
(6)滴定至终点时的现象为____________。
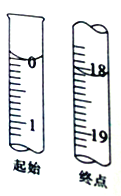
(7)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL,计算所得样品的纯度为_________(用含W的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是

A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com