
【题目】图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质。(反应过程中生成的水及其他产物已略去)
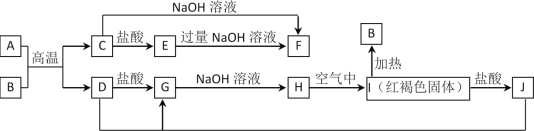
请回答以下问题:
(1)B是__________,H是_______________。(填化学式)
(2)写出J与D反应转化为G的离子方程式_________________________________。
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学方程式_______。
【答案】Fe2O3 Fe(OH)2 2Fe3++Fe=3Fe2+ 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
A、D为常见金属单质,B、C为金属氧化物,反应条件是高温进行,可以判断为铝热反应,可以推断A为Al,D为Fe,B为铁的氧化物,结合C与氢氧化钠反应证明C为Al2O3,E为AlCl3,F为NaAlO2,通过转化关系判断,G为FeCl2,H为白色沉淀Fe(OH)2,I为红褐色沉淀Fe(OH)3,B为Fe2O3,J为FeCl3,依据判断结果分析解答问题。
A、D为常见金属单质,B、C为金属氧化物,反应条件是高温进行,可以判断为铝热反应,可以推断A为Al,D为Fe,B为铁的氧化物,结合C与氢氧化钠反应证明C为Al2O3,E为AlCl3,F为NaAlO2,通过转化关系判断,G为FeCl2,H为白色沉淀Fe(OH)2,I为红褐色沉淀Fe(OH)3,B为Fe2O3,J为FeCl3;
(1)依据分析判断可知B为:Fe2O3;H的化学式为:Fe(OH)2;故答案为:Fe2O3;Fe(OH)2;
(2)反应“J+D→G”的离子方程式为铁和三氯化铁的氧化还原反应,离子方程式为:2Fe3++Fe=3Fe2+;故答案为:2Fe3++Fe=3Fe2+;
(3)A为Al在常温下也可与NaOH溶液反应生成F为偏铝酸钠,反应的化学方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业规模海水提溴的常用方法。其中一种工艺流程为:①海水浓缩,酸化;②通入Cl2,使Br— 转化为Br2;③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;④通入Cl2,再经过一系列处理得到产品Br2。请回答下列问题:
(1)步骤②、③操作的目的是_____(填“富集溴”或“萃取溴”);
(2)在步骤③中,生成HBr的化学方程式是___________;
(3)在步骤②中,若通入22.4LCl2(标准状况),理论上可得Br2__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A.2.5 g NaD与足量水反应生成的氢气中含中子数0. 1NA
B.0.1 mol H2O与0. 1 mol H2O2含H—O键数目均为0. 2NA
C.0.1 mol Na2CO3NaHCO32H2O溶于水形成的1 L溶液中CO32一和HCO3一数目之和为0.2NA
D.电解精炼铜时,阴极增重64 g时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式是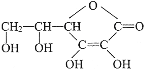 ,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23、三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3+ Br2+ 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为________,每生成2.24 LO2(标准状况)转移电子数为__________。
24、在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是________________________,相应的离子方程式是_______________________。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) ---------------①
Cl2(aq) ---------------①
Cl2(aq)+ H2O![]() HClO + H++Cl------②
HClO + H++Cl------②
HClO![]() H++ ClO----------------③
H++ ClO----------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
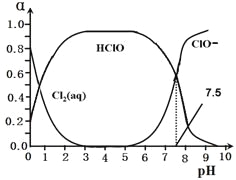
25、写出上述体系中属于电离平衡的平衡常数表达式:Ki =_______,由图可知该常数值为_________。
26、在该体系中c(HClO) + c(ClO-)_______c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
27、用氯处理饮用水时,夏季的杀菌效果比冬季______(填“好”或“差”),请用勒夏特列原理解释________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
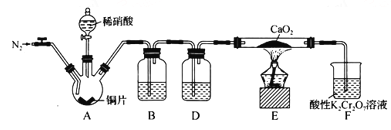
A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:
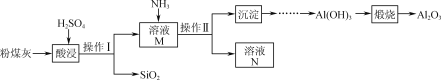
(1)操作Ⅰ的名称是________;溶液N中的溶质主要是____________(填化学式)。
(2)用H2SO4“酸浸”时的离子方程式为__________________________________(任写一个)。
(3)“煅烧”时的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态原子由原子核和绕核运动的电子组成,下列有关核外电子说法正确的是
A.基态原子的核外电子填充的能层数与元素所在的周期数相等
B.基态原子的核外电子填充的轨道总数一定大于或等于![]() (m表示原子核外电子数)
(m表示原子核外电子数)
C.基态原子的核外电子填充的能级总数为![]() (n为原子的电子层数)
(n为原子的电子层数)
D.基态原子的核外电子运动都有顺时针和逆时针两种自旋状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com