
����Ŀ��A��B��C��D��E�Ǻ˵����������������ֶ���������Ԫ�أ�Aԭ�Ӻ���ֻ��1�����ӣ�Bԭ�Ӱ뾶����������������С�ģ�B������������Ӧ��ˮ����Ļ�ѧʽΪHBO3��Cԭ�������ĵ������ȴ����Ķ�4��C�ļ���������D�������Ӿ�����ͬ�ĵ��Ӳ�ṹ����Ԫ�ؿ��γɻ�����D2C��C��Eͬ���塣�ش��������⣺
(1)B��Ԫ�����ڱ��е�λ��Ϊ______________________��
(2)B��C��D��E�γɵļ����Ӱ뾶�ɴ�С�Ĺ�ϵ��________________(�����ӷ��ű�ʾ)��
(3)�õ���ʽ��ʾ������D2C���γɹ���______________________��
(4)��A��B��C����Ԫ���γɵij��������ӻ�����Ļ�ѧʽΪ___________���û������ˮ��Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊ______________________��
(5)������D2EC3��һ�������¿��Է����ֽⷴӦ���������Σ�����һ�ֲ���Ϊ�������Σ���˷�Ӧ�Ļ�ѧ����ʽΪ______________________��
���𰸡��ڶ����ڵ���A�� S2-��N3-��O2-��Na+ ![]() NH4NO3 c(NO3-) �� c(NH4+)�� c(H+)�� c(OH-) 4Na2SO3
NH4NO3 c(NO3-) �� c(NH4+)�� c(H+)�� c(OH-) 4Na2SO3![]() Na2S+ 3Na2SO4
Na2S+ 3Na2SO4
��������
A��B��C��D��E�Ǻ˵����������������ֶ���������Ԫ�أ�AԪ�ص�ԭ�Ӻ���ֻ��1�����ӣ���AΪHԪ�أ�BԪ�ص�ԭ�Ӱ뾶����������������С�ģ����ڵڶ����ڣ�B������������Ӧˮ����Ļ�ѧʽΪHBO3��BԪ���������Ϊ+5����BΪNԪ�أ�CԪ��ԭ�ӵ������������ȴ�����4����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�C����������D�������Ӿ�����ͬ�ĵ����Ų������Ӻ��������Ϊ10����Ԫ�ؿ��γɻ�����D2C��DԪ�ػ��ϼ�Ϊ+1������IA�壬��DΪNa��C��Eͬ���壬��EΪSԪ�أ��ݴ˽��
(1)BΪNԪ�أ�ԭ�Ӻ�����2�����Ӳ㣬����������Ϊ5����λ�����ڱ��еڶ����ڢ�A�壻
(2)Ԫ��B��C��D��E�γɵ����ӷֱ�ΪN3-��O2-��Na+��S2-��S2-���Ӻ�����3�����Ӳ㣬���Ӱ뾶���N3-��O2-��Na+���Ӻ�������Ų���ͬ������2�����Ӳ㣬�˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶N3-��O2-��Na+��
(3)������D2CΪNa2O��Ϊ���ӻ�����õ���ʽ��ʾ���γɹ���Ϊ![]() ��
��
(4)��A��B��C����Ԫ���γɵ���ΪNH4NO3��NH4NO3��ˮ��Һ��NH4+ˮ��ʹ��Һ�����ԣ�����Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊc(NO3-) �� c(NH4+)�� c(H+)��c(OH-)��
(5)������D2EC3ΪNa2SO3����һ�������¿��Է����ֽⷴӦ���������Σ�����һ�ֲ���Ϊ�������Σ�ӦΪNa2S����������ԭ��Ӧ�ĵ����غ���ɣ���һ�ֲ���ӦΪNa2SO4���ʷ�Ӧ�Ļ�ѧ����ʽΪ4Na2SO3![]() Na2S+3Na2SO4��
Na2S+3Na2SO4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1874��22��ķ��ػ����27����ձ����ֱ����̼��������ѧ˵�������˷��ӵ���������ͼ��ʾ���ܱ�ʾ����ķ��ӽṹ����һ�ָ��ܷ�ӳ����ʵ����״��(����)
A.�ṹʾ��ͼ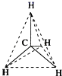 B.����ģ��
B.����ģ��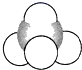
C.���ģ��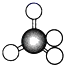 D.����ʽ
D.����ʽ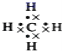
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ž��з���Ԫ��������150���ꡣ�±���Ԫ�����ڱ���һ���֣�W��X��Y��ZΪ����������Ԫ�أ�W��X������ϼ�֮��Ϊ8������˵���������

A. ԭ�Ӱ뾶��W<X
B. ���³�ѹ�£�Y����Ϊ��̬
C. ��̬�⻯�����ȶ��ԣ�Z<W
D. X������������ˮ������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����͵���������ֱ���ŷŻ��������صĻ������⣬��ش��������⣺
(1)���л���������Ҫ����������͵���������ŷ���������___________��
A.ȫ���ů B.���� C.ˮ�帻Ӫ����(ˮ��) D.��ɫ��Ⱦ
(2)SO2���ŷ���Ҫ������ú��ȼ�ա�����ʯ��ʯ���������������������ϡ�
��֪��CaCO3(s)=CO2(g)+CaO(s) ��H=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ��H=��402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ��H=��234.2kJ/mol
д��CaCO3��SO2������Ȼ�ѧ��Ӧ����ʽ_____________________________________��
(3)NOx���ŷ���Ҫ����������β��������NO2��NO����������û���̿��NOx����������������Ӧ���£�
��Ӧa��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H=��34.0kJ/mol
N2(g)+CO2(g) ��H=��34.0kJ/mol
��Ӧb��2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ��H=��64.2kJ/mol
N2(g)+2CO2(g) ��H=��64.2kJ/mol
���ڷ�Ӧa����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�������
Ũ��(molL-1) | ʱ��(min) | |||||
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��0~10min�ڣ�NO��ƽ����Ӧ����v(NO)=___________�������߷�Ӧ�¶ȣ��÷�Ӧ��ƽ�ⳣ��K___________(ѡ���������С�����䡱)��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣻�����ϱ��е������жϸı������������___________(����ĸ)��
A.����һ�����Ļ���̿ B.ͨ��һ������NO
C.�ʵ���С��������� D.������ʵĴ���
(4)ijʵ����ģ�ⷴӦb���ں�ѹ�ܱ������м��������Ļ���̿��һ������NO���壬���NO��ת���� ��(NO)���¶ȵı仯��ͼ��ʾ��
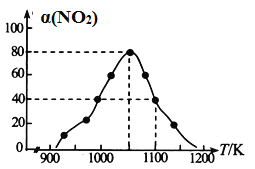
����ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��(����Kp)����1050K��1.1��106Pa ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp��________(ֻ�г�����ʽ)(��֪�������ѹ��������ѹ���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ���![]() ��ij��Ʒ����
��ij��Ʒ����![]() ��ѧ�����ⶨ������������;�����������Ե�����ָʾ������
��ѧ�����ⶨ������������;�����������Ե�����ָʾ������![]() ����Һ�ζ������
����Һ�ζ������![]() ��Ũ�ȡ����з�����ȷ����
��Ũ�ȡ����з�����ȷ����
��֪��![]() ����
����![]()
����һ![]() ��Ʒ
��Ʒ![]()
![]()
![]() -
-![]()
![]()
![]()
![]()
![]()
������![]() ��Ʒ
��Ʒ![]()
![]() I2
I2![]()
![]()
A.����������Ʒ��������������㣬�������IJⶨ��ȷ
B.������Һ����ɫ��Ϊ��ɫʱ���ﵽ�ζ��յ�
C.����һ�뷽��������������ƷŨ�ȱ�Ϊ6��l
D.���������������õ�������һ������![]() ����Һ������Ƿ�������6��
����Һ������Ƿ�������6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������

A. ͼI��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯
B. ͼ���ʾ�����£�0.1000mol��L-1 NaOH��Һ�ζ�20.00mL 0.1000mol��L-1 CH3COOH��Һ���õ��ĵζ�����
C. ͼ���ʾһ�������ı������ˮϡ�����У���Һ�ĵ��������仯���ߣ�ͼ��a��b��c�������ĵ���̶ȣ�a��b��c
D. ͼ����ʾ��Ӧ4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ��H ��0���������������������¸ı���ʼ��CO�����ʵ���,ƽ��ʱN2����������仯�������ͼ��֪NO2��ת����b>a>c
N2(g)+4CO2(g) ��H ��0���������������������¸ı���ʼ��CO�����ʵ���,ƽ��ʱN2����������仯�������ͼ��֪NO2��ת����b>a>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Դ�����Ӧ��ǰ������Դ֮һ���ߴ�����Ʊ���Ŀǰ���о��ȵ㡣������̫���ܹ����ص��ˮ�Ƹߴ��⣬����ʾ��ͼ���¡�ͨ�����ƿ�������K1��K2���ɽ���õ�H2��O2������˵����ȷ���ǣ� ��
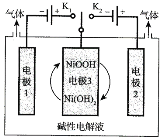
A.��H2ʱ����������K2
B.����H2�ĵ缫3��Ӧʽ��NiOOH+ e- + H2O = Ni(OH)2 +OH-
C.�缫1��缫2��������������ʵ�����Ϊ1:2
D.�缫3�ڿ�������K1�� K2ʱ�ֱ�����������Ӧ�ͻ�ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(һ)��֪25 ��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | Ka��1.8��10��5 | Ka1��4.3��10��7 Ka2��5.6��10��11 | Ka��3.0��10��8 |
�ش��������⣺
��1�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ��
a��CH3COONa ��b��Na2CO3�� c��NaClO�� d��NaHCO3
pH��С��������˳����_____________(�ñ����д)��
��2�������£�0.1 mol/L��CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����________��
A��c(H��) B��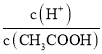 C��c(H��)��c(OH��) D��
C��c(H��)��c(OH��) D��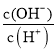 E��
E�� ![]()
��3����NaClO��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ_____��
(��)�ڳ����£�����������Һ��
��0.1molL��1NH4Cl��Һ����0.1molL��1CH3COONH4��Һ����0.1molL��1NH4HSO4��Һ��0.1molL��1NH3H2O��0.1molL��1NH4Cl�Ļ����Һ����0.1molL��1NH3H2O��Һ
�����Ҫ����д���пհף�
��1��������������Һ�У�pH��С����_____��c��NH4+����С����_____��������ţ�
��2���Ƚ���Һ�ڡ�����c��NH4+���Ĵ�С��ϵ�Ǣ�_____�ۣ���������������������������
��3������Һ���У�_____��Ũ��Ϊ0.1molL��1��NH3H2O��_____�����ʵ���Ũ��֮��Ϊ0.2molL��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У�������ƿ��ʢ��ij�����壬�ձ��͵ι���ʢ��ij����Һ����ѹ�ιܵĽ�ͷ��Ȼ���ֹˮ�У�������ʵ����ʵ�������
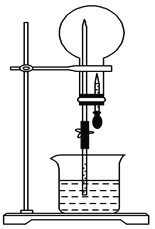
A. NH3(H2O����ɫʯ����Һ)����ɫ��Ȫ
B. SO2(NaOH��Һ)����ɫ��Ȫ
C. HCl(H2O����ɫʯ����Һ)����ɫ��Ȫ
D. NO(NaOH��Һ)����ɫ��Ȫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com