
【题目】(一)已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是_____________(用编号填写)。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________。
A.c(H+) B.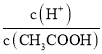 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.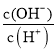 E.
E. ![]()
(3)向NaClO溶液中通入少量CO2,所发生反应的化学方程式为_____。
(二)在常温下,下列五种溶液:
①0.1molL﹣1NH4Cl溶液 ②0.1molL﹣1CH3COONH4溶液 ③0.1molL﹣1NH4HSO4溶液④0.1molL﹣1NH3H2O和0.1molL﹣1NH4Cl的混合溶液 ⑤0.1molL﹣1NH3H2O溶液
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是_____。(填序号)
(2)比较溶液②、③中c(NH4+)的大小关系是②_____③(填“>”“<”或“=”)。
(3)在溶液④中,_____的浓度为0.1molL﹣1;NH3H2O和_____的物质的量浓度之和为0.2molL﹣1。
【答案】a<d<c<b BD ClO-+CO2+H2O═HClO+HCO3- ③ ⑤ < Cl- NH4+
【解析】
(一)(1)根据表格数据,酸性:CH3COOH>H2CO3>HClO>HCO3-。酸根离子对应酸的酸性越强,该离子的水解程度越小,溶液的pH越小;
(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,醋酸分子物质的量减小,浓度减小,酸性减弱,结合温度不变,水的离子积常数不变,醋酸的电离平衡常数不变分析判断;
(3)酸性强弱HClO>HCO3-,书写二者反应的离子方程式;
(二)(1)五种0.1mol/L含NH4+的溶液,要考虑NH4+的水解以及H+、CH3COO-等条件对NH4+水解平衡的影响,依据另一种离子的影响分析判断;
(2)醋酸根离子水解促进铵根离子水解,NH4HSO4 溶液中的氢离子抑制铵根离子的水解;
(3)混合溶液中氯离子浓度不变为0.1mol/L;依据溶液中氮元素的物料守恒分析判断。
(一)(1)根据表格数据,酸性:CH3COOH>H2CO3>HClO>HCO3-。四种溶液的溶质都是强碱弱酸盐,物质的量浓度均为0.1 mol·L-1时,水解程度大小为:CO32->ClO->HCO3->CH3COO-,水解均显碱性,水解程度越大,碱性越强,所以碱性顺序是:Na2CO3>NaClO>NaHCO3>CH3COONa,即pH由小到大的排列顺序为:CH3COONa<NaHCO3<NaClO<Na2CO3,即:a<d<c<b,故答案为:a<d<c<b;
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱。
A、加水稀释醋酸,氢离子浓度减小,故A错误;
B、加水稀释醋酸过程中,促进醋酸的电离,氢离子物质的量增大,醋酸分子物质的量减小,所以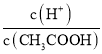 增大,故B正确;
增大,故B正确;
C、温度不变,水的离子积常数不变,故C错误;
D、醋酸溶液加水稀释时,酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,所以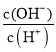 增大,故D正确;
增大,故D正确;
E、温度不变,醋酸的电离平衡常数不变,即![]() 不变,故E错误;
不变,故E错误;
故答案为:BD;
(3)酸性强弱HClO>HCO3-,根据强酸制取弱酸,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,故答案为:ClO-+CO2+H2O═HClO+HCO3-;
(二)(1)以①0.1mol/L NH4Cl中铵根离子浓度略小于0.1mol/L为标准;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于①;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于①,溶液显酸性;④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;⑤0.1mol/L NH3H2O,一水合氨是弱碱存在电离平衡,电离程度较小,溶液中铵根离子浓度远小于0.1mol/L,小于①,溶液呈碱性;所以溶液pH最小的是③,铵根离子浓度最小的是⑤,故答案为:③;⑤;
(2)根据(1)的分析,②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于①;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于①,c(NH4+):②<③,故答案为:<;
(3)④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液中,氯离子浓度不变为0.1mol/L;根据氮元素守恒得到NH3H2O和NH4+浓度为0.2mol/L,故答案为:Cl-;NH4+。


科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)B、C、D、E形成的简单离子半径由大到小的关系是________________(用离子符号表示)。
(3)用电子式表示化合物D2C的形成过程______________________。
(4)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液中各离子的浓度由大到小的顺序为______________________。
(5)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NaCl晶体的一个晶胞的结构模型(黑球为Cl-、白球为Na+)。KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则下列对于KO2晶体结构的描述不正确的是( )
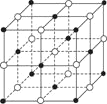
A.与K+距离相等且最近的K+有8个
B.与K+距离相等且最近的O2-构成的多面体是正八面体
C.一个KO2晶胞中的K+和O2-粒子数均为4个
D.与K+距离相等且最近的O2-共有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推法在化学学习过程中广泛使用,如下四项推测,其中正确的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据结构和组成相似的物质,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3
C.CO2中的C采用sp杂化轨道成键,CS2中的C也是采用sp杂化轨道成键
D.CH4的空间结构为正四面体,键角为109°28′,P4的空间结构也为正四面体,键角为109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理,实验时关闭图1中的a,用单孔塞(插有吸入水的胶头滴管)塞紧颈口c,将水挤入三颈烧瓶中,打开b,完成喷泉实验。电脑绘制三颈烧瓶内压强变化曲线图2。下列说法正确的是 ( )

A.干燥氨气通常可选用浓硫酸B.三颈烧瓶内可以看到红色喷泉
C.图1中氧化钙可用氯化钙代替D.由图2可知C点时喷泉最剧烈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com