
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是___________。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出CaCO3与SO2脱硫的热化学反应方程式_____________________________________。
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
浓度(molL-1) | 时间(min) | |||||
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)某实验室模拟反应b,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
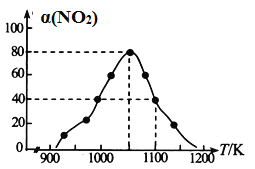
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(只列出计算式)(已知:气体分压=气体总压×体积分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是_____________(用编号填写)。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________。
A.c(H+) B.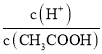 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.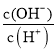 E.
E. ![]()
(3)向NaClO溶液中通入少量CO2,所发生反应的化学方程式为_____。
(二)在常温下,下列五种溶液:
①0.1molL﹣1NH4Cl溶液 ②0.1molL﹣1CH3COONH4溶液 ③0.1molL﹣1NH4HSO4溶液④0.1molL﹣1NH3H2O和0.1molL﹣1NH4Cl的混合溶液 ⑤0.1molL﹣1NH3H2O溶液
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是_____。(填序号)
(2)比较溶液②、③中c(NH4+)的大小关系是②_____③(填“>”“<”或“=”)。
(3)在溶液④中,_____的浓度为0.1molL﹣1;NH3H2O和_____的物质的量浓度之和为0.2molL﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反应过程示意图如下:

下列关于上述反应的说法不正确的是
A. Cu纳米颗粒将氢气解离成氢原子
B. MG是中间产物
C. DMO分子断裂的化学键有:C-O和C一H
D. 该反应生成物中有一种与乙醇是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。元素Y基态原子的3p轨道上有5个电子。元素Z的原子最外层电子数是其内层的3倍。元素W基态原子核外电子共有16种运动状态。
⑴①在元素周期表中,元素Y位于第___________周期第___________族,元素X位于___________区;
②Z所在周期中,第一电离能最大的元素是___________;(填元素名称)
③X+的核外电子排布式为___________;与X同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有___________(填元素符号)
④Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是___________(填化学式)
⑵X与Y所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,X离子的数目为___________
②该化合物的化学式为___________
⑶X与W的最高价含氧酸的浓溶液反应的化学方程式为___________
⑷①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是___________
②稳定性:H2Z___________H2W(填“<”、“>”或“=”),其主要原因是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是
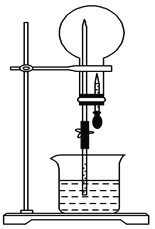
A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种18电子离子和两种10电子离子。W、X、Y、Z均为短周期元素,且均不在同一主族。下列说法不正确的是( )

A.X与W形成的简单化合物沸点高于X同族元素与W形成的简单化合物的沸点
B.Z的最高价氧化物对应水化物的酸性比Y的强
C.Y气态氢化物的稳定性比X的强
D.如图化合物中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙烷的分子结构可简写成键线式结构![]() 。有机物A的键线式结构为
。有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是
A. 有机物A的一氯代物只有5种
B. 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C. B的结构可能有3种,其中一种名称为3,4,4-三甲基-2-戊烯
D. 若有机物C与H2以1:2加成生成A,C的结构只有1种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com