
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)钠在空气中燃烧,得到的产物化学式为___,它的电子式为___。
(2)将一小块金属钠(2.3g)投入100mL水中,发生反应的离子方程式为__;可观察到的实验现象是__(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)向(2)所得溶液中加入5.4g铝单质充分反应,写出反应的化学方程式___,转移电子数目为___。
(4)Fe跟Cl2在一定条件下反应,所得产物的化学式是___。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,现象为___,反应的离子方程式是___。
【答案】Na2O2 ![]() 2Na+2H2O→2Na++2OH-+H2↑ bc 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 0.3NA FeCl3 红 生成红褐色沉淀 Fe3++3OH-=Fe(OH)3↓
2Na+2H2O→2Na++2OH-+H2↑ bc 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 0.3NA FeCl3 红 生成红褐色沉淀 Fe3++3OH-=Fe(OH)3↓
【解析】
(1)钠在空气中燃烧,生成过氧化钠,过氧化钠剩余离子化合物,据此分析解答;
(2)Na可与水反应生成NaOH和H2,结合Na的物理性质判断可能观察到的现象;
(3)铝能与NaOH溶液反应生成偏铝酸钠和氢气,根据氢氧化钠和铝的物质的量计算判断;
(4)Fe和Cl2反应生成FeCl3,结合Fe3+的性质解答该题。
(1)钠在空气中燃烧,生成过氧化钠(Na2O2),电子式为![]() ,故答案为:Na2O2;
,故答案为:Na2O2;![]() ;
;
(2)Na可与水反应生成NaOH和H2,反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,由于钠的密度比水小,可观察到钠浮在水面上,并四处游动,因钠的熔点较低,反应放热,则可观察到钠熔成小球,故答案为:2Na+2H2O═2Na++2OH-+H2↑;bc;
(3)铝能与NaOH溶液反应生成偏铝酸钠和氢气,2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑,5.4g铝的物质的量为![]() =0.2mol,氢氧化钠的物质的量=
=0.2mol,氢氧化钠的物质的量=![]() =0.1mol,反应后氢氧化钠完全反应,铝剩余0.1mol,反应中铝由0价变成+3价,转移电子0.3mol,数目为0.3NA,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;0.3NA;
=0.1mol,反应后氢氧化钠完全反应,铝剩余0.1mol,反应中铝由0价变成+3价,转移电子0.3mol,数目为0.3NA,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;0.3NA;
(4)Fe和Cl2反应生成FeCl3,Fe3+与KSCN溶液反应生成血红色溶液,与NaOH溶液溶液反应生成红褐色沉淀Fe(OH)3,Fe3++3OH-═Fe(OH)3↓,故答案为:FeCl3;红(或血红);生成红褐色沉;Fe3++3OH-═Fe(OH)3↓。


科目:高中化学 来源: 题型:
【题目】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料。实验室可用苯甲醛和乙酸酐、醋酸钠等原料经下列反应制取肉桂酸,其中苯甲醛为无色油状液体。已知:
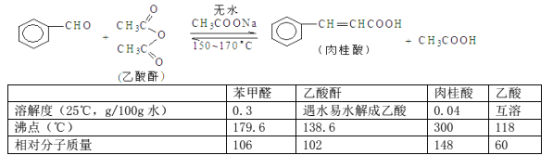
填空:
Ⅰ.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。
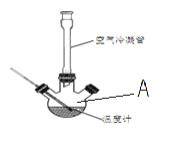
(1)仪器A的名称为___。
(2)空气冷凝管的作用是__,该装置加热要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是__。
(3)不能把无水CH3COONa换成CH3COONa·3H2O的原因是__。
Ⅱ.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下用加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有__。水蒸气蒸馏可除去的杂质是__;如何判断蒸馏终点___。
(5)若得到的肉桂酸晶体产品不纯,应采用__可得到纯度更高的产品。
(6)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是__(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了验证难溶的氯化银在水中也存在溶解平衡,设计了如下实验方案:( )
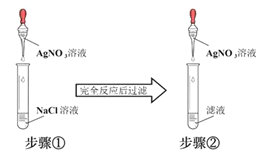
A.步骤①中应加入过量的AgNO3溶液
B.步骤①中应使NaCl溶液过量
C.步骤②中现象是无沉淀产生
D.步骤②中选用的AgNO3溶液浓度应小于步骤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱工业始于 18 世纪末,至今已有两百多年。在纯碱工业史上,比利时人索尔维,中国人侯德榜等都作出了突出的贡献。据此完成下面小题。
【1】下图是1861年索尔维发明的制碱法中物质转化关系图,其中I~IV代表四个主要化学反应,a~i代表除H2O以外不同的物质。若不计其他损耗,,下列说法正确的是( )
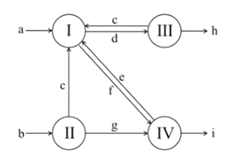
A.水溶液呈碱性的物质只有e、g、h
B.水溶液呈酸性的物质只有c、f、i
C.每消耗1mol a,同时消耗0.5mol b
D.每消耗1mol h,同时消耗0.5mol i
【2】从母液中析出的NaHCO3中含有NH4Cl,需洗涤后再进行灼烧。若省略洗涤操作,则最终对所得纯碱纯度影响叙述正确的是( )
A.无明显影响B.NH4Cl杂质含量上升
C.NaCl杂质含量上升D.NaOH杂质含量上升
【3】化工专家侯德榜发明的"侯氏制碱法"大大推进了纯碱工业的发展,其最重要贡献是( )
A.找到了新型高效的催化剂B.充分利用了能量
C.提高了纯碱产品的纯度D.提升了Na+的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质变化的化学用语正确的是( )
A.氯化铝与氨水反应的离子方程式:Al3++3OH-=Al(OH)3↓
B.铁发生吸氧腐蚀的正极反应:O2+2H2O+4e=4OH-
C.碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
D.稀硫酸溶液中滴加少量氢氧化钡溶液:H++SO42++Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了约翰·班尼斯特·古迪纳夫、迈克尔·斯坦利·惠廷汉姆和吉野彰,以表彰他们对锂离子电池研发的贡献。目前最安全的锂离子电池是LiFePO4电池,结构如图所示,电池中间是聚合物的隔膜,只允许Li+通过。
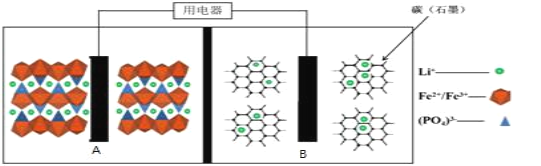
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A.放电时,B电极发生氧化反应
B.放电时,导线转移1mol电子,B电极室质量减少7xg
C.充电时,A极电极反应式:xLiFePO4-xe-=xFePO4+xLi+
D.充电时,Li+从A电极室向B电极室移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的描述正确的是( )
选项 | 实验内容 | 现象或结论 |
A | 向平衡体系FeCl3+3KSCN | 溶液颜色明显变浅 |
B | 用NaOH溶液滴定盐酸(酚酞作指示剂)至终点 | 溶液由红色变为无色 |
C | 二氧化硫通入到酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色,SO2具有还原性 |
D | 将钠置于一定量的乙醇中 | 钠浮在液面上剧烈反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O![]() C2O
C2O![]() +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O![]() 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )

A. Ka1=10-1.2
B. pH=2.7时溶液中:![]() =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com