
【题目】下列叙述中正确的是( )
A. CO2是酸性氧化物 B. 由一种元素组成的物质一定是单质
C. 单质只能用置换反应制取 D. 含氧元素的化合物称为氧化物
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 处于最低能童的原子叫做基态原子
B. 对于组成和结构相似的分子,其范德华力随若相对分子质量的增大而增大
C. 化学键可以是原子间作用力,也可以是离子间作用力
D. 3p2表示3p能级有两个轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用坩埚钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是
A. 火焰温度太低不能使铝燃烧
B. 铝在空气中不能很快形成氧化膜
C. 氧化铝的熔点比铝的熔点高
D. 用酸处理时未能将氧化铝溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
硒化锌是一种透明色半导体,也可作为红外光学材料,熔点是1 520 ℃。
(1)基态锌原子的价电子排布式是________。
(2)根据元素周期律,电负性Se________S,第一电离能Se________As(填“>”或“<”)。
(3)H2S分子的电子式:________,H2Se分子构型是_______,
其中硒原子的杂化轨道类型是________。
(4)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是________。
(5)晶体Zn为六方最密堆积,其配位数是________。
(6)ZnSe晶胞如图,假设阿伏加德罗常数的值为NA,则144 g ZnSe晶体中的晶胞数是________。
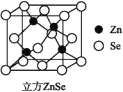
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d9,该元素在周期表中的位置是( )
A.第三周期Ⅷ族,p区B.第三周期ⅤB族,d区
C.第四周期ⅠB族,ds区D.第四周期ⅤB族,f区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为________。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为________(已知该反应为置换反应)。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为________,K的原子结构示意图为________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是
A. Fe3+与KSCN产生血红色沉淀
B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2
C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤
D. 赤铁矿的主要成分是Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
I.从废液中提纯并结晶出FeSO4·7H2O;
Ⅱ.将FeSO4·7H2O配制成溶液
Ⅲ.将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体;
V.煅烧FeCO3,得到Fe2O3固体
已知:NH4HCO3在热水中分解
(1)I中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是____。
(2)Ⅱ中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用______________。
(3)Ⅲ中,生成FeCO3的离子方程式是________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是 __________。
(5)已知煅烧FeCO3的化学方程式是:____________。现煅烧464.0 kg FeCO3,得到316.8 kg产品。若产品中杂质只有Fe2O3,则该产品中Fe2O3的质量是____kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com