
����Ŀ���������������������뷢չ����Ҫ���ʻ�����
��1����ͨ��������Ҫ�ɷ���Na2SiO3��CaSiO3��___(�ѧʽ)����������������IJ�����___������
��2���ڸ��ϲ�������������ɣ�,һ������___����һ������______,��_____����һ�ָ��ϲ��ϡ�
��3��������ˮ�����Ҫ�ɷ���_______, Ϊ����ˮ���Ӳ���ٶ�,����ˮ���м���___��
��4����ҵ����ˮ��Ͳ������õ��Ĺ�ͬԭ����______,��ˮ����մ����õ��Ĺ�ͬԭ����___��
���𰸡� SiO2 �ֻ� ���� ��ǿ�� ������ά��ǿ����(������) 3CaO��SiO2��2CaO��SiO2��3CaO��Al2O3 ʯ�� ʯ��ʯ ���
����������1��������ͨ������ԭ���Ǵ��ʯ��ʯ������ʯӢ���ڸ�������ʱ��������Ҫ��Ӧ��Na2CO3��SiO2![]() Na2SiO3��CO2��CaCO3��SiO2
Na2SiO3��CO2��CaCO3��SiO2![]() CaSiO3��CO2������ʯӢ������������ͨ��������Ҫ�ɷ�ΪNa2SiO3��CaSiO3��SiO2���ֻ���������ͨ������������������ȴ���Ƴɵģ����л�еǿ�ȴ�������������ŵ�����ʹ����Ҳû�м������ǣ������������������ij���������
CaSiO3��CO2������ʯӢ������������ͨ��������Ҫ�ɷ�ΪNa2SiO3��CaSiO3��SiO2���ֻ���������ͨ������������������ȴ���Ƴɵģ����л�еǿ�ȴ�������������ŵ�����ʹ����Ҳû�м������ǣ������������������ij���������
��2�����ϲ����ǽ����ֻ������������ʲ�ͬ�IJ��Ͼ�������ӹ����Ƴɵģ�����������ɣ�һ���������壬������������һ����Ϊ��ǿ�壬��Ǽ����ã���̼��ά�������ֵȶ��Ǹ��ϲ��ϡ�
��3��������ˮ������ʯ��ʯ�����Ϊԭ�Ͼ����ӹ��������������ӵ�������ѧ�仯�Ƴɵģ�����ҪΪ���ǹ����Σ���ѧʽд����3CaO��SiO2��2CaO��SiO2��3CaO��Al2O3������ʯ�����ڵ���ˮ���Ӳ���ٶȣ��������䡢������ʩ����
��4��������ͨ������ԭ���Ǵ��ʯ��ʯ��ʯӢ������ˮ��ԭ������ʯ��ʯ������������մɵ�ԭ�Ͼ�����������Թ�ҵ������ˮ��Ͳ����õ��Ĺ�ͬԭ����ʯ��ʯ,����ˮ����մ��õ��Ĺ�ͬԭ���������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵����ȷ���ǣ� ��
A. �ö��Ե缫���1 L 1mol/L CuSO4��Һ�������õ���ͭԭ�ӵ���Ŀһ��ΪNA
B. ��2.3g��Ͷ�뵽100ml 0.8mol/L��ϡ�����У���ȫ��Ӧ��ɵõ�H2����ĿΪ0.01NA
C. 1molCl2����ˮ����Һ��Cl2��HClO��ClO����Cl��������������Ϊ2NA
D. ��״���£�2molNa2O2��44.8LSO2��ȫ��Ӧ��ת�Ƶĵ�����ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������茶��������֯���ľ�ļӹ��ķ�����ȡ��ɶ������̵���ԭ����ȡ������茶��岽�����£�
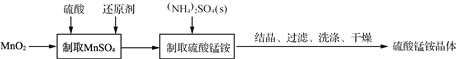
��1��ʵ��ǰ�������MnO2��������������Ϊ____________________________��
��2�� ����ȡMnSO4��ʱ������C6H12O6(������)��H2C2O4(����)����������ԭ����
����C6H12O6����ԭ��(������ΪCO2)ʱ��������Ӧ��n(MnO2)/n(C6H12O6)��________����
����H2C2O4����ԭ����������Ӧ�Ļ�ѧ����ʽΪ____________________________��
��3��һ�ֲⶨ������茶���[��Ϊ�� (NH4)xMny(SO4)z��wH2O]��ɵķ������£�
����ȡһ������������茶������250 mL��ҺA��
��ȡ25.00 mL��ҺA����������BaCl2��Һ��BaSO4 0.512 6 g��
����ȡ25.00 mL��ҺA����10 mL 20%�����Լ�ȩ��Һ��ҡ�ȡ�����5 min[4NH![]() ��6HCHO===3H����6H2O��(CH2)6N4H�����ζ�ʱ��1 mol(CH2)6N4H����1 mol H���൱]������1��2�η�̪��Һ����0.100 0 mol��L��1 NaOH����Һ�ζ����յ�(�ڸù�����Mn2��������)������NaOH��Һ22.00 mL��
��6HCHO===3H����6H2O��(CH2)6N4H�����ζ�ʱ��1 mol(CH2)6N4H����1 mol H���൱]������1��2�η�̪��Һ����0.100 0 mol��L��1 NaOH����Һ�ζ����յ�(�ڸù�����Mn2��������)������NaOH��Һ22.00 mL��
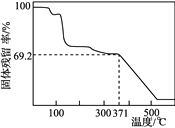
��ȡһ������Ʒ�ڿ����м�������Ʒ�Ĺ��������(������Ʒ��ʣ������/������Ʒ����ʼ������100%)���¶ȵı仯����ͼ��ʾ(��Ʒ��371 ��ʱ����ȫʧȥ�ᾧˮ)����������ʵ�����ݼ���ȷ��������茶���Ļ�ѧʽ(д���������)��__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ͬһ��Һ��һ���ܴ����������(����)
A. ������Ba2������Һ�У�Cl����K����SO![]() ��CO
��CO![]()
B. ������H������Һ�У�Mg2����Na����CO![]() ��SO
��SO![]()
C. ������OH������Һ�У�K����NO��SO![]() ��Cu2��
��Cu2��
D. ������Na������Һ�У�H����K����SO![]() ��NO
��NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�û���ʵ�뽺�������û�й�ϵ���ǣ� ��
A.��������������ˮ
B.���Ȼ�����Һ�еμ�NaOH��Һ���ֺ��ɫ����
C.�峿�������ï�ܵ����ֲ��������Ĺ���
D.��ʯ�����±���ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A������Ӧ��Ũ�ȿ��������Ӱٷ��������Է�Ӧ��������
B�����ȷ�Ӧ�ķ�Ӧ����һ���������ȷ�Ӧ�ķ�Ӧ����
C����ӦNH3(g) + HCl(g)![]() NH4Cl(s)�������¿��Է���������÷�Ӧ����H��0
NH4Cl(s)�������¿��Է���������÷�Ӧ����H��0
D�����ڷ�ӦX(s)��aY(g)![]() bZ(g)��W(g) ��H��0�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С
bZ(g)��W(g) ��H��0�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��ɴﵽʵ��Ŀ�ĵ��ǣ� ��
A. �� ![]() �� NaOH ��ˮ��Һ�����Ʊ�CH3CH=CH2
�� NaOH ��ˮ��Һ�����Ʊ�CH3CH=CH2
B. �üױ���ϡ���ᡢϡ����Ļ���������ȡ TNT
C. �ױ����廯������������Һ�巴Ӧ���� 2��4��6-����ױ�
D. �� CH3CH2Br �е��� AgNO3 ��Һ�Ϳ��Լ�����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������480mL0.1mol/L������ͭ��Һ����ѡ�ú��ʵ�����ƿ�������ƣ����²�����ȷ����
A.��ȡ7.68g����ͭ�����500mL��Һ
B.��ȡ8.0g����ͭ������500mLˮ
C.��ȡ12.5g������CuSO4��5H2O�����500mL��Һ
D.��ȡ12.0g������CuSO4��5H2O�����500mL��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol/L��ijһԪ��HR��Һ����μ���0.1mol/L��ˮ��������ҺpH�����������仯��ͼ�����з�������ȷ���ǣ� ��

A. a��b�㵼��������ǿ˵��HRΪ����
B. a��b����ʾ��Һ��ˮ�ĵ���̶Ȳ���ͬ
C. bǡ����ȫ�кͣ�pH=7˵��NH4Rû��ˮ��
D. c ����Һ����c��NH4+����c��R-����c��OH-����c��H+��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com