
【题目】下列实验可达到实验目的的是( )
A. 将 ![]() 与 NaOH 的水溶液共热制备CH3CH=CH2
与 NaOH 的水溶液共热制备CH3CH=CH2
B. 用甲苯与稀硝酸、稀硫酸的混合酸相混制取 TNT
C. 甲苯在溴化铁催化作用下与液溴反应生成 2,4,6-三溴甲苯
D. 向 CH3CH2Br 中滴入 AgNO3 溶液就可以检验溴元素
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl、SO42—、NH4+、CO32—、K+、Na+。为确认溶液组成进行如下实验:
①200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有____,可能存在的离子有______;
(2)原溶液中c(CO32—)为____,c(NH4+)____c(SO42—) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl)__c(SO42—) (填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是( )
A. 热稳定性:Na2CO3>NaHCO3 B. 酸性:H2CO3>H2SiO3
C. 碱性:NaOH>LiOH D. 热稳定性:HF>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存与发展的重要物质基础。
(1)普通玻璃的主要成分是Na2SiO3、CaSiO3和___(填化学式)。用于汽车或火车车窗的玻璃是___玻璃。
(2)在复合材料由两部分组成,,一部分作___,另一部分作______,如_____就是一种复合材料。
(3)硅酸盐水泥的主要成分是_______, 为调节水泥的硬化速度,常在水泥中加入___。
(4)工业上制水泥和玻璃需用到的共同原料是______,制水泥和陶瓷需用到的共同原料是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成的盐只有NaH2PO2一种。等浓度的次磷酸(H3PO2)溶液与盐酸,前者导电能力弱。下列说法错误的是( )
A.H3PO2中,P元素的化合价为+1价
B.H3PO2为一元弱酸,NaH2PO2溶液呈碱性。
C.次磷酸在水中的电离方程式为H3PO2+H2O![]() H2PO2—+ H3O+
H2PO2—+ H3O+
D.NaH2PO2属于酸式盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)=0时,c(H+)=1×10-2mol/L
B. V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C. V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D. V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某课外兴趣小组对X进行如下实验探究:

下列说法正确的是( )
A. 12.8g固体可能为Fe2O3 B. 混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
C. Fe2O3、Cu的物质的量之比为1:1 D. m>24.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为Na3AlF6 ,其中含有_______________________________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中所含元素电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________,它的氢化物的沸点比同主族其它氢化物的沸点高,原因是:_______________________________。
(4)冰晶石由两种微粒构成,它的晶胞结构如图甲所示,小黑点“●”位于大立方体的顶点和面心,小圆圈“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处小三角“”所代表的是__________(填“小黑点”或“小圆圈”),它代表的是______________(填微粒化学式)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
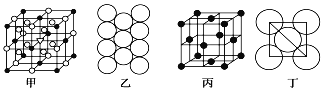
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为__________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液里大量共存的是
A.K+、Na+、OH-、Cl-B.Mg2+、Na+、SO42-、OH-
C.Cu2+、Ba2+、SO42-、Cl-D.H+、Ca2+、CO32-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com