
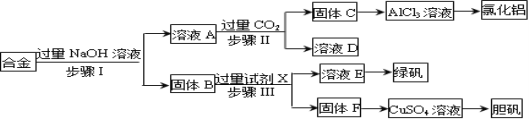
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取无水氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体。
请回答:
【制备无水氯化铝】
(1)步骤Ⅰ进行的实验操作所需要的玻璃仪器是 ;
(2)步骤Ⅱ生成固体C的离子方程式是 ;
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 ;
(4)由AlCl3溶液制备无水AlCl3的实验过程如下:
①由AlCl3溶液制备氯化铝晶体(AlCl36H2O)涉及的操作为: 、冷却结晶、过滤、洗涤;
②将AlCl36H2O溶于浓硫酸进行蒸馏,可以得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母)。
a.氧化性 b.吸水性 c.难挥发性 d.脱水性
【制备胆矾晶体】
(5)用固体F制备CuSO4溶液,可设计以下三种途径,你认为的最佳途径为 。(填序号)


【测定FeSO47H2O含量】
(6)称取制得的绿矾样品10.0 g,溶于适量的稀硫酸中,配成100 mL溶液,准确量取25.00 mL该液体于锥形瓶中,再用0.1000 mol/L KMnO4标准溶液滴定。用同样的方法滴定3次,平均消耗15.00 mL标准液,则样品中FeSO47H2O的质量分数为 。(已知Mr(FeSO4·7H2O)=278)
【答案】(1)漏斗、烧杯、玻璃棒(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)在装置a、b之间增加一个盛有饱和NaHCO3溶液的洗气瓶(合理即可) (4)①蒸发浓缩
②b c(5)②(6)83.4%
【解析】
试题分析:铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体。
(1)步骤Ⅰ进行的实验操作是过滤,所需要的玻璃仪器是漏斗、烧杯、玻璃棒;
(2)根据以上分析可知步骤Ⅱ生成固体C的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢;
(4)①由AlCl3溶液制备氯化铝晶体(AlCl36H2O)涉及的操作为蒸发浓缩、冷却结晶、过滤、洗涤;
②浓硫酸具有吸水性和难挥发性,因此将AlCl36H2O溶于浓硫酸进行蒸馏,可以得到一定量的无水AlCl3。
(5)金属铜可以和硝酸之间反应生成硝酸铜、一氧化氮和水,即3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,所以途径②最佳。
(6)根据电子得失守恒可知样品中FeSO47H2O的质量分数为
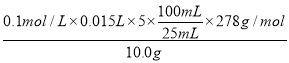 ×100%=83.4%。
×100%=83.4%。


科目:高中化学 来源: 题型:
【题目】下图为含有少量Zn杂质的粗银电解精炼银的示意图

(1) (填a或b)极为含有杂质的粗银。
(2)电解一段时间后电解液中c(Ag+)浓度________(填偏大,偏小或不变)。
(3)若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.用硫氰化钾溶液检验Fe3+:Fe3++3SCN﹣![]() Fe(SCN)3↓
Fe(SCN)3↓
B.向海带灰浸出液中加入稀硫酸、双氧水:2I﹣+2H++H2O2![]() I2+2H2O
I2+2H2O
C.磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH﹣![]() Na2SiO3↓+H2O
Na2SiO3↓+H2O
D.NaHCO3溶液和少量Ba(OH)2溶液混合:+OH﹣+Ba2+![]() H2O+BaCO3↓
H2O+BaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2![]() Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是
Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是
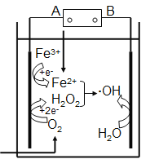
A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-![]() ·OH + H+
·OH + H+
D.消耗1molO2,可以产生4mol ·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
C.硅胶可做袋装食品的干燥剂
D.晶体硅可用于制作半导体材料与其熔点高硬度大无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验式相同,但既不是同系物,又不是同分异构体的是 ( )
A.1-戊烯和2-甲基丙烯
B.甲醛和甲酸甲酯
C.1-丁醇与甲醚
D.丙酸和甲酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 化学与生活密切相关。下列说法正确的是( )
A. 福尔马林可作食品的保鲜剂
B. 乙烯可作水果的催熟剂
C. 做衣服的棉和麻均与淀粉互为同分异构体
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多沙唑嗪盐酸盐是一种用于治疗高血压的药物。多沙唑嗪的合成路线如下:
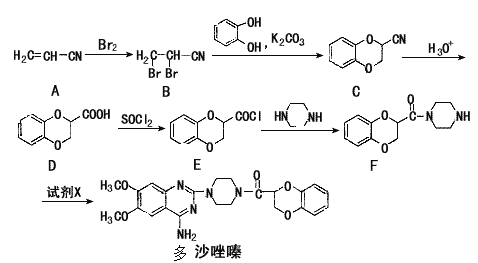
(1)写出D中两种含氧官能团的名称:______和_____。
(2)写出满足下列条件的D的两种同分异构体的结构简式_______________________。
①苯的衍生物,且苯环上的一取代产物只有两种;②与Na2CO3溶液反应放出气体;
③水解后的产物才能与FeCl3溶液发生显色反应。
(3)E→F的反应中还可能生成一种有机副产物,该副产物的结构简式为____________。
(4)由F制备多沙唑嗪的反应中要加入试剂X(C10H10N3O2Cl),X的结构简式为_______。
(5)苯乙酸乙酯是一种常见的合成香料。请设计合理的方案以苯甲醛和乙醇为原料合成
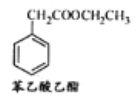
苯乙酸乙酯(用合成路线流程图表示,并注明反应条件)。
提示:①R-Br+Na→R-CN+NaBr;
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
CH3CH2OH ![]() H2C=CH2
H2C=CH2![]() BrH2C-CH2Br
BrH2C-CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.胶体的丁达尔效应与微粒直径大小有关
B.氨气的水溶液能导电,因此是NH3电解质
C.电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关
D.向饱和氯化钠溶液中加入一小块钠,溶液中有固体析岀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com