
【题目】下图为含有少量Zn杂质的粗银电解精炼银的示意图

(1) (填a或b)极为含有杂质的粗银。
(2)电解一段时间后电解液中c(Ag+)浓度________(填偏大,偏小或不变)。
(3)若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类依次排列正确的是
A. 硫酸、纯碱、石灰石 B. 氢硫酸、烧碱、绿矾
C. 石炭酸、熟石膏、醋酸钠 D. 磷酸、乙醇钠、苛性钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,同属还原反应的是 ( )
A.原电池正极和电解池阳极所发生的反应
B.原电池正极和电解池阴极所发生的反应
C.原电池负极和电解池阳极所发生的反应
D.原电池负极和电解池阴极所发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】利用天然气合成氨的工艺流程示意如下,完成下列填空:
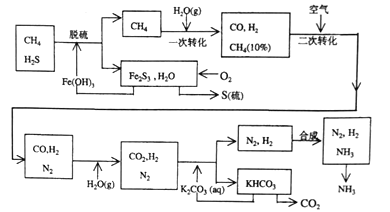
(1)天然气脱硫采用了Fe(OH)3,Fe(OH)3可以再生循环,可以再生循环.写出上述工艺中由Fe2S3再生Fe(OH)3的化学方程式是 。含硫化合物遇到Fe3+的反应情况与反应条件有关.以NaHS溶液与FeCl3溶液混合为例:将溶液置于80°C的热水浴中,发现有红褐色沉淀生成,写出该反应的化学方程式: 。解释该反应在温度升高后能发生,而低温时不易发生的原因 。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2___mol(用含n的代数式表示)
(3)K2CO3和CO2又反应在加压下进行.加压的理论依据是 (多选扣分)
a.相似相溶原理
b.勒夏特列原理
c.艘喊中和原理
(4)整个流程有兰处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,还有一处循环未标明.请指出上述流程图中第三处循环的物质是 ·
(5)工业上制取的硝酸铵的流程图如下.请回答下列问题:
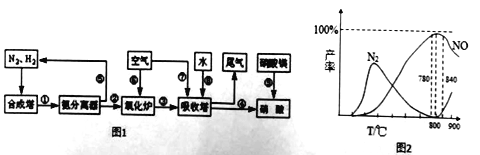
据图2可知工业上氨催化氧生成NO时.应该控制温度在 左右.其中在吸收塔中为了尽可能提高硝酸的产率,减少尾气排放.常常调节空气与NO的比例.写出吸收塔内发生反应的总化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析生产生活中的下列过程,不涉及氧化还原反应的是( )
A.煤液化制得清洁能源 B.人工固氮
C.将氯气通入冷的消石灰中制漂白粉 D.从海水中提取氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为______,并写出其所有可能的结构简式:__________________。
(2)某烷烃的相对分子质量为128,该烷烃的化学式为__________________。
(3)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气混合,点燃完全反应后再恢复到原来的温度时,气体体积不变,则该烃分子内的氢原子个数______。
A.小于4 B.大于4
C.等于4 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于加成反应的是( )
A.乙炔通入酸性高锰酸钾溶液中,溶液褪色
B.苯滴入溴水中,振荡后溴水层接近无色
C.油脂的皂化反应
D.将裂化获得的汽油滴入溴水中,溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取无水氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体。
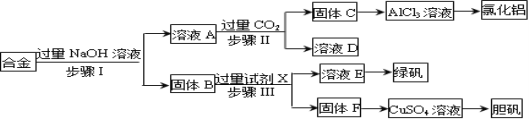
请回答:
【制备无水氯化铝】
(1)步骤Ⅰ进行的实验操作所需要的玻璃仪器是 ;
(2)步骤Ⅱ生成固体C的离子方程式是 ;
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 ;
(4)由AlCl3溶液制备无水AlCl3的实验过程如下:
①由AlCl3溶液制备氯化铝晶体(AlCl36H2O)涉及的操作为: 、冷却结晶、过滤、洗涤;
②将AlCl36H2O溶于浓硫酸进行蒸馏,可以得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母)。
a.氧化性 b.吸水性 c.难挥发性 d.脱水性
【制备胆矾晶体】
(5)用固体F制备CuSO4溶液,可设计以下三种途径,你认为的最佳途径为 。(填序号)


【测定FeSO47H2O含量】
(6)称取制得的绿矾样品10.0 g,溶于适量的稀硫酸中,配成100 mL溶液,准确量取25.00 mL该液体于锥形瓶中,再用0.1000 mol/L KMnO4标准溶液滴定。用同样的方法滴定3次,平均消耗15.00 mL标准液,则样品中FeSO47H2O的质量分数为 。(已知Mr(FeSO4·7H2O)=278)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com