
����Ŀ����1����H2��g��+![]() O2��g��= H2O��l�� ��H= ��285.8 kJ/mol
O2��g��= H2O��l�� ��H= ��285.8 kJ/mol
��H2��g��+![]() O2��g��= H2O��g�� ��H= ��241.8kJ/mol
O2��g��= H2O��g�� ��H= ��241.8kJ/mol
��C(s)+![]() O2 (g) = CO (g) ��H= ��110.5kJ/mol
O2 (g) = CO (g) ��H= ��110.5kJ/mol
��C(s)+ O2 (g) = CO2 (g) ��H= ��393.5kJ/mol
�ش��������⣺
������Ӧ�����ڷ��ȵ���_________��H2��ȼ����Ϊ________��C��ȼ����Ϊ_____��
��2�����͵���Ҫ�ɷ������飨C8H18����1 mol C8H18��l����O2��g����ȼ�գ�����CO2��g����H2O��l�����ų�5518 kJ��������д���˷�Ӧ���Ȼ�ѧ����ʽ___________
��3����������������Ӧ����1molˮ��������241.8kJ����1gˮ����ת����Һ̬ˮʱ����2.444kJ����д��������ȼ���ȵ��Ȼ�ѧ����ʽ________
���𰸡��٢ڢۢ� 285.8 kJ/mol 393.5 kJ/mol C8H18��l��+![]() O2��g��=8CO2��g��+9H2O��l�� ��H=-5518kJ/mol H2(g)+
O2��g��=8CO2��g��+9H2O��l�� ��H=-5518kJ/mol H2(g)+![]() O2(g)=H2O (l) ��H=-285.792kJ/mol
O2(g)=H2O (l) ��H=-285.792kJ/mol
��������
��1��������Ӧ���ǡ�H��0�ķ�Ӧ�����Ƿ��ȷ�Ӧ���ʴ�Ϊ���٢ڢۢܣ�
������ȼ������ָ1mol����ȼ������Һ̬ˮʱ�ų���������C��ȼ������ָ1molCȼ�����ɶ�����̼ʱ�ų�����������Ϸ�Ӧ�٢ܿ�֪��������ȼ����Ϊ285.8kJ/mol��C��ȼ����Ϊ��393.5kJ/mol���ʴ�Ϊ��285.8kJ/mol��393.5kJ/mol��
��2��1molC8H18��l������O2��g����ȼ�գ�����CO2��g����H2O��l�����ų�5518kJ�������÷�Ӧ���Ȼ�ѧ����ʽΪC8H18��l��+![]() O2��g��=8CO2��g��+9H2O��l����H=-5518kJ/mol��
O2��g��=8CO2��g��+9H2O��l����H=-5518kJ/mol��
��3��������������Ӧ����1molˮ��������241.8kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��H2��g��+![]() O2��g��=H2O��g����H=-241.8kJ/mol��
O2��g��=H2O��g����H=-241.8kJ/mol��
1gˮ����ת����Һ̬ˮ����2.444kJ����18gˮ����ת����Һ̬ˮ�ų�����2.444kJ��18=43.992kJ���ʷ�ӦH2��g��+![]() O2��g��=H2O��l���ķ�Ӧ�ȡ�H=-��241.8kJ/mol+43.992kJ/mol��=-285.792kJ/mol��������ȼ���ȷ���ʽΪ��H2��g��+
O2��g��=H2O��l���ķ�Ӧ�ȡ�H=-��241.8kJ/mol+43.992kJ/mol��=-285.792kJ/mol��������ȼ���ȷ���ʽΪ��H2��g��+![]() O2��g��=H2O��l����H=-285.792kJ/mol��
O2��g��=H2O��l����H=-285.792kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ������ش��������⣺
��1�����淴ӦFeO(s)��CO(g)![]() Fe(s)��CO2(g)��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
Fe(s)��CO2(g)��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
���÷�Ӧ������̶����ܱ������н��У���һ�������´ﵽƽ��״̬���������¶ȣ���������ƽ����Է�������__�����뺤�������������ܶ�__(��������������С������������)��
��2��830�棬��ӦCO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)��ƽ�ⳣ��K=1����2L���ݷ�Ӧ���з���������Ӧ���ֱ����3molCO2��2molH2��1molCH3OH��4molH2O(g)����Ӧ��__������С�������������桱���ƶ�����
CH3OH(g)��H2O(g)��ƽ�ⳣ��K=1����2L���ݷ�Ӧ���з���������Ӧ���ֱ����3molCO2��2molH2��1molCH3OH��4molH2O(g)����Ӧ��__������С�������������桱���ƶ�����
��3��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | NH3��H2O | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | 1.7��10-5 | 1.7��10-5 | K1��4.3��10-7 K2��5.6��10-11 | K1��1.3��10-2 K2��6.3��10-8 |
��д��CH3COOH�ĵ��뷽��ʽ____�������ƽ�ⳣ������ʽK a=___��
�ڸ��ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01mol��L-1�������������ʵ���Һ�У�������ǿ����___(����)�������и���Һ�ֱ�ϡ��100����pH�仯��С����___(����)��
A��CH3COOH B��H2CO3 C��H2SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ���ǣ� ��
A.2��������Ҳ���춡��
B.C4H9Cl��3��ͬ���칹��
C.�������4��̼ԭ�ӿ�����ͬһֱ����
D.���顢���顢����Ľṹ��ֻ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ�����ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ������г�����������ɳ��Ca2����Mg2����SO42-���������ӡ�Ϊ��ȥ�����е�Ca2����Mg2����SO42-�Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£�
![]()
(1)Ϊ��ȥCa2����Mg2����SO42-������ڡ������������������Һ(���ڳ������Լ��Թ���)�������˳��Ϊ_____________(����ĸ)��
A��Na2CO3������B��BaCl2������C��NaOH
(2)��д����������漰��Ӧ�����ӷ���ʽ�� ______________________________________��
(3)�����ᴿ���������������жദʹ�õ������������������������ʹ�ò�������������_____________________________________��
(4)���ȼ������ٹ��ˣ������ᴿЧ������Ӱ�죬��ԭ����_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��1���������з�Ӧ��2SO2 + O2 ![]() 2SO3 �� ���2min��SO2��Ũ����8 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________�������ʼʱSO2Ũ��Ϊ4mol/L��2min��Ӧ��ƽ�⣬�����ʱ����v(O2)Ϊ0.5mol/(L��min)����ô2minʱSO2��Ũ��Ϊ_____________��
2SO3 �� ���2min��SO2��Ũ����8 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________�������ʼʱSO2Ũ��Ϊ4mol/L��2min��Ӧ��ƽ�⣬�����ʱ����v(O2)Ϊ0.5mol/(L��min)����ô2minʱSO2��Ũ��Ϊ_____________��
��2����ͼ��ʾ���ܱ������з�Ӧ��2SO2+O2![]() 2SO3 ��H<0 �ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������____________��b c�����иı������������____________�� ������ѹǿʱ����Ӧ�ٶȱ仯�������c-d��__________.
2SO3 ��H<0 �ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������____________��b c�����иı������������____________�� ������ѹǿʱ����Ӧ�ٶȱ仯�������c-d��__________.
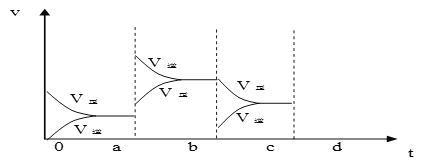
��3���������е���ƽ�⣺NH3��H2O![]() NH4+ + OH -����ʹc(NH4+)����Ĵ�ʩ�ǣ�_________
NH4+ + OH -����ʹc(NH4+)����Ĵ�ʩ�ǣ�_________
�������¶� �ڼӰ��� ��ˮ �� NH4Cl��Һ ��NaOH��Һ ������������
II.��һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��____________��
��2���÷�ӦΪ____________��Ӧ��ѡ�����ȡ����ȣ���
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��3c��CO2����c��H2����5c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ____________�棻
��4��830��ʱ����������м���1LCO2��1LH2��ƽ��ʱCO2�����������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������֮���ת����ϵ����ͼ��ʾ����Ӧ����ʡ�ԣ����ֲ���ʡ�ԣ��������ƶϲ���ȷ���ǣ�������

A.��LΪǿ���E����ΪNaCl��Һ��FΪK
B.��LΪǿ�ᣬ��E����ΪNa2S��FΪH2O2
C.��LΪ���ᣬ��E����ΪMg��FΪCO2
D.��LΪǿ�ᣬ��E����ΪNH4Cl��FΪCa(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������SO32-��I����Br�������ʵ����ֱ�Ϊm��n��6 mol ��������Һ��ͨ��������������Һ�����������ӵ����ʵ����ı仯��ͼ��ʾ������˵������ȷ����(����)
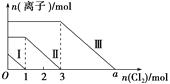
A.���ߢ����Br���ı仯���
B.���ߢ��Ӧ�ķ�Ӧ��SO32-��Cl2��H2O=2H����SO42-��2Cl��
C.ͨ�������Ϊ5 molʱ����Һ�е���Ҫ������ΪCl����SO32-
D.��Һ��n(Na��)��n(SO32-)��n(I��)��n(Br��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����32.0gͭ��60.0mLһ��Ũ�ȵ����ᷢ�����·�Ӧ��Cu��4HNO3 = Cu(NO3)2��2NO2����2H2O��3Cu��8HNO3 = 3Cu(NO3)2��2NO����4H2O��ͭ��ȫ�ܽ�����Ļ���������Ϊ8.96L(���)�������(�����ݱ�����λ��Ч����)��
(1)NO�����Ϊ______
(2)�û�������ƽ��Ħ������ԼΪ______
(3)������������ȫ���ͷź�����Һ����100mL 2.0mol/L��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���Һ�����Ӵ��ں�ת���ı���������ǣ� ��
A.������Һ�п��ܴ�������Fe3+��K+��Cl-��SO![]()
B.���ӷ���ʽ2Ca2++3HCO![]() +3OH-�T2CaCO3��+CO
+3OH-�T2CaCO3��+CO![]() +3H2O���Ա�ʾNH4HCO3�����ʯ��ˮ��Ӧ
+3H2O���Ա�ʾNH4HCO3�����ʯ��ˮ��Ӧ
C.��ˮ�������c��H+��=1��10-12mol/L����Һ�п��ܴ�������K+��I-��Mg2+��NO![]()
D.n[NH4Al(SO4)2]��n[Ba(OH)2]=2��5ʱ�����ķ�ӦΪNH![]() +Al3++2SO
+Al3++2SO![]() +2Ba2++5OH-�TNH3H2O+AlO
+2Ba2++5OH-�TNH3H2O+AlO![]() +2H2O+2BaSO4��
+2H2O+2BaSO4��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com