
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗盐中常含有少量泥沙及Ca2+、Mg2+、SO42-等杂质离子。为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1)为除去Ca2+、Mg2+、SO42-,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量);加入的顺序为_____________(填字母)。
A.Na2CO3 B.BaCl2 C.NaOH
(2)请写出步骤⑥中涉及反应的离子方程式: ______________________________________。
(3)粗盐提纯的整个操作过程中多处使用到玻璃棒,步骤⑦蒸发过程中使用玻璃棒的作用是_____________________________________。
(4)若先加盐酸再过滤,将对提纯效果产生影响,其原因是_____________________________。
【答案】BCA(CBA或BAC) CO32-+2H+===H2O+CO2↑、OH-+H+===H2O 搅拌,防止局部过热使液体飞溅 在酸性条件下会有部分沉淀溶解,从而影响精盐的纯度
【解析】
粗盐中含难溶的泥沙以及可溶性杂质(钙离子、镁离子、硫酸根),通过第①步溶解,再通过第②③④步添加除掉可溶性杂质的试剂,将钙离子、镁离子、硫酸根离子沉淀下来,再过滤,便可除掉难溶性杂质泥沙,还有可溶性杂质也转化成了难溶的沉淀;由于除杂试剂是过量的,所以滤液中含杂质:CO32-、OH-,用盐酸与之反应除去,当然盐酸也是过量的,盐酸易挥发,在第⑦步中除去。
(1)碳酸钠必须在氯化钡的后面,原因是过量的碳酸根既保证除掉钙离子,又保证了除掉前面过量的钡离子,NaOH无先后顺序,所以加入的顺序可以是①BaCl2、Na2CO3、NaOH;②BaCl2、NaOH、Na2CO3;③NaOH、BaCl2、Na2CO3,故答案为:BCA(CBA或BAC);
(2)滤液中含杂质:过量的CO32-、OH-,盐酸中的氢离子与碳酸根反应生成二氧化碳和水,与氢氧根反应生成水,故答案为:CO32-+2H+=H2O+CO2↑;OH-+H+=H2O;
(3)蒸发结晶实验中,持续加热,玻璃棒的作用是搅拌,防止局部过热使液体飞溅,故答案为:搅拌,防止局部过热使液体飞测;
(4)产生的沉淀有氢氧化镁、碳酸钙、硫酸钡、碳酸钡,其中氢氧化镁、碳酸钙、碳酸钡会溶于稀盐酸,重新进入溶液,达不到除杂目的。若先加盐酸再过滤,将对提纯效果产生影响,其原因是在酸性条件下会有部分沉淀溶解,从而影响精盐的纯度,故答案为:在酸性条件下会有部分沉淀溶解,从而影响精盐的纯度。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )

A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀最严重区域应该是生锈最多的区域
C. 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-===4OH-
D. 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.在100 mL 1 molL1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++![]() +4H+
+4H+
B.在100 mL 2 molL1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2![]() +Ca2++2OH-═CaCO3↓+2H2O+
+Ca2++2OH-═CaCO3↓+2H2O+![]()
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2![]() +2Ba2++4OH-═2BaSO4↓+
+2Ba2++4OH-═2BaSO4↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中。纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是
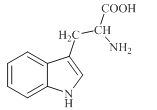
A.色氨酸的分子式为C11H12N2O2
B.色氨酸能发生取代、加成、酯化、中和反应
C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐
D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①H2(g)+![]() O2(g)= H2O(l) △H= —285.8 kJ/mol
O2(g)= H2O(l) △H= —285.8 kJ/mol
②H2(g)+![]() O2(g)= H2O(g) △H= —241.8kJ/mol
O2(g)= H2O(g) △H= —241.8kJ/mol
③C(s)+![]() O2 (g) = CO (g) △H= —110.5kJ/mol
O2 (g) = CO (g) △H= —110.5kJ/mol
④C(s)+ O2 (g) = CO2 (g) △H= —393.5kJ/mol
回答下列问题:
上述反应中属于放热的是_________;H2的燃烧热为________;C的燃烧热为_____;
(2)汽油的重要成分是辛烷(C8H18),1 mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518 kJ热量。请写出此反应的热化学方程式___________
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444kJ,试写出氢气的燃烧热的热化学方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生成氮肥的原料。回答下列问题:
(1)氮气的电子式________________ ,氨的结构式__________________;
(2)氨水显碱性,写出氨水的电离方程式___________________________________________;
(3)氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W 的原子序数依次增大,X、Y 为有机物中常见元素,Y、Z、W 同周期,由四种元素形成的化合物甲的结构如图。下列说法正确的是
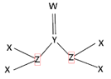
A.最高化合价:W>Z>Y>X
B.蛋白质中一定含有这四种元素
C.(YZ)2 与 X2W2 均为直线型分子
D.化合物甲的一种同分异构体可能既有离子键又有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com