
【题目】下列关于有机化合物的说法正确的是( )
A.2-甲基丁烷也称异丁烷
B.C4H9Cl有3种同分异构体
C.正丁烷的4个碳原子可以在同一直线上
D.甲烷、乙烷、丙烷的结构都只有一种
【答案】D
【解析】
A. 2-甲基丁烷也称异戊烷,A错误;
B. C4H9Cl有C-C-C-C、和![]() 两种碳链结构,这两种碳链结构分别有两种不同位置的H原子,其中的H原子被Cl原子取代,都会产生2种同分异构体,则C4H9Cl有4种同分异构体,B错误;
两种碳链结构,这两种碳链结构分别有两种不同位置的H原子,其中的H原子被Cl原子取代,都会产生2种同分异构体,则C4H9Cl有4种同分异构体,B错误;
C.正丁烷中的C原子都是饱和C原子,与饱和C原子连接的四个原子构成的是四面体结构,所以正丁烷分子中的4个碳原子不可能在同一直线上,C错误;
D.甲烷是正四面体结构,四个H原子位置相同,所以不存在同分异构体;乙烷可看作是甲烷分子中的一个H原子被-CH3取代产生的物质,不存在同分异构体;丙烷分子可看作是甲烷分子中的2个H原子被-CH3取代产生的物质,不存在同分异构体,所以甲烷、乙烷、丙烷的结构都只有一种,D正确;
故合理选项是D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾[K3Fe(C2O4)33H2O]是制备负载型活性铁催化剂的主要原料。某化学小组探究用废铁屑(含少量-2价S元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体。具体流程如图:
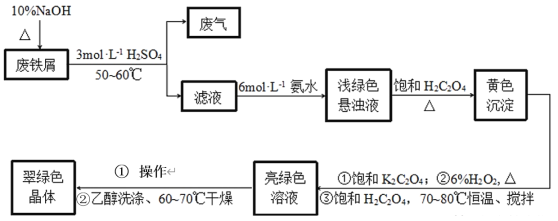
已知:①(NH4)2Fe(SO4)26H2O为蓝绿色晶体,FeC2O4·2H2O为难溶于水的黄色晶体,K3Fe(C2O4)3·3H2O为可溶于水、难溶于乙醇的翠绿色晶体。
②25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O![]() (aq) K=6.31×10-17。
(aq) K=6.31×10-17。
③[Fe(SCN)]2+(aq)为血红色。
回答下列问题:
(1)三草酸合铁酸钾[K3Fe(C2O4)33H2O]中铁的化合价是_____。
(2)废铁屑中加入10%NaOH并加热的目的是__。
(3)为防止污染空气,反应所产生的“废气”可选择__净化处理。(填选项)
A.H2O B.NaOH溶液 C.盐酸 D.CuSO4溶液
(4)写出浅绿色悬浊液中加入饱和H2C2O4生成黄色沉淀的化学方程式:__。
(5)制备过程中加入6%H2O2的目的是__,温度保持70~80℃,采用的合适加热方式是__。
(6)获得翠绿晶体的操作①是___。
(7)用乙醇洗涤晶体的原因是___。
(8)某同学欲检验所制晶体中的Fe(Ⅲ),取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1molL-1KSCN溶液。请判断上述实验方案是否可行并说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年6月比亚迪正式发布刀片电池,大幅度提高了电动汽车的续航里程可媲美特斯拉,刀片电池采用磷酸铁锂技术。可利用钛铁矿[主要成分为FeTiO3(难溶性亚铁盐),还含有少量MgO等杂质]来制备LiFePO4和Li4Ti5O12等锂离子电池的电极材料,工艺流程如图:
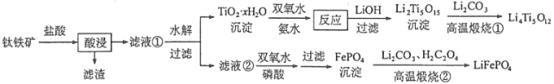
回答下列问题:
(1)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式 _______。
(2)TiO2xH2O沉淀与双氧水、氨水“反应”转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示:
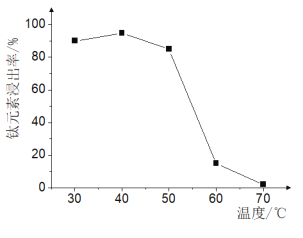
反应温度过高时,Ti元素浸出率变化的原因是 ________。
(3)“滤液②”中含有的金属离子是 _______;加入双氧水和磷酸使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时溶液中 c(PO43-)=________。(FePO4的 Ksp=1.3×10 -22)
(4)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
(5)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为_____。
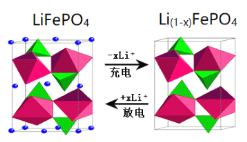
(6)作为刀片电池正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,则正极电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )

A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀最严重区域应该是生锈最多的区域
C. 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-===4OH-
D. 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化法冶金过程中产生大量的含氰废水(主要包括CN-、Cu(CN)32-、SO32-等离子),可以通过沉淀——电解氧化法进行处理,某小组同学对该过程进行模拟。
资料1:溶液中存在平衡Cu(CN)32-![]() CuCN↓+2CN-
CuCN↓+2CN-
资料2:2Cu2++4CN-=2CuCN ↓+(CN)2
(1)利用CuCl2溶液对含氰废水进行初步沉淀处理。溶液中总氰(CNT)、游离氰(CN-)的去除率随CuCl2加入量变化趋势如图所示。

CuCl2加入量对总氰(CNT)、游离氰(CN-)去除率的影响
①请用平衡移动原理解释,随着CuCl2加入量增大(3.0 g以前),溶液中总氰(CNT)、游离氰(CN-)的去除率变化趋势_________。
②在SO32-的作用下,CuCl2可将废水中的Cu(CN)32-直接转化为CuCN沉淀,该过程的离子方程式为__________。
(2)利用钛电极对沉淀后的废液中残留的CN-等离子进一步进行电解处理,在一定的电压下,在阳极观察到明显的气泡,经检验,其主要成分为N2和CO2。该小组同学实验时发现,若将(1)中沉淀剂CuCl2换为CuSO4,电解法几乎不能去除CN-。
①下列关于电解氧化法处理废水的说法正确的是__________。
A.阳极处观察到的气泡主要是由于 CN-在阳极放电产生的
B.电解结束之后,该小组同学在阴极处能回收金属铜
C.电解法处理过程中,Cu(CN)32-向阳极迁移
②CN-中包含碳氮三键,该离子中碳元素的化合价为 ______。
③请用化学用语解释电解过程中Cl-的作用:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.在100 mL 1 molL1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++![]() +4H+
+4H+
B.在100 mL 2 molL1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2![]() +Ca2++2OH-═CaCO3↓+2H2O+
+Ca2++2OH-═CaCO3↓+2H2O+![]()
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2![]() +2Ba2++4OH-═2BaSO4↓+
+2Ba2++4OH-═2BaSO4↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中。纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是
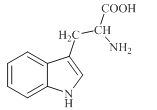
A.色氨酸的分子式为C11H12N2O2
B.色氨酸能发生取代、加成、酯化、中和反应
C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐
D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①H2(g)+![]() O2(g)= H2O(l) △H= —285.8 kJ/mol
O2(g)= H2O(l) △H= —285.8 kJ/mol
②H2(g)+![]() O2(g)= H2O(g) △H= —241.8kJ/mol
O2(g)= H2O(g) △H= —241.8kJ/mol
③C(s)+![]() O2 (g) = CO (g) △H= —110.5kJ/mol
O2 (g) = CO (g) △H= —110.5kJ/mol
④C(s)+ O2 (g) = CO2 (g) △H= —393.5kJ/mol
回答下列问题:
上述反应中属于放热的是_________;H2的燃烧热为________;C的燃烧热为_____;
(2)汽油的重要成分是辛烷(C8H18),1 mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518 kJ热量。请写出此反应的热化学方程式___________
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444kJ,试写出氢气的燃烧热的热化学方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各装置不能达到实验目的是
A.利用①吸收多余的氨气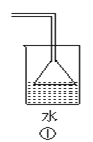
B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥氨气
D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com