



科目:高中化学 来源: 题型:
| 1 |
| 5 |
| A、①②④ | B、①④⑤ |
| C、②④⑥ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、草酸氢钾溶液呈酸性,在0.1mol?L-1 KHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| B、在小苏打水溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| C、相同温度下,1mol?L-1氨水溶液与0.5mol?L-1氨水溶液中,c(OH-)之比是2:1 |
| D、当氨水与盐酸恰好完全反应时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| +NaOH溶液,过滤 |
| ① |
| △ |
| ② |
| +H2△ |
| ③ |
| +过量铁粉,过滤 |
| ① |
| △ |
| ② |
| +H2△ |
| ③ |
| +过量铁粉,过滤 |
| ① |
| +稀盐酸,过滤 |
| ② |
| △ |
| ③ |
| +H2,△ |
| ④ |
| A、丙方案回收铜较好,但也发生环境污染 |
| B、乙方案中加过量铁粉可以将三种阳离子全部还原 |
| C、甲方案中的反应涉及置换、分解、化合、复分解四种反应类型 |
| D、三种实验方案中都能制得纯净铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
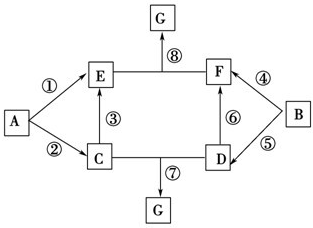 A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).
A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com