
【题目】同主族常见的三种元素 X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为:HXO4<HYO4<HZO4 , 下列判断不正确的是( )
A.Y 单质可以在海水中提取
B.单质氧化性:Y>Z
C.气态氢化物稳定性:HX<HZ
D.离子半径:X﹣>Y﹣
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A. t2时加入了催化剂 B. t3时降低了温度
C. t5时增大了压强 D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X常被用于制香料或作为饮料酸化剂,在医学上也有广泛用途。物质X的结构简式如下图所示,下列关于物质X的说法正确的是( )
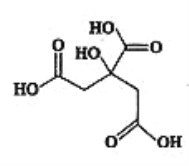
A. X的分子式为C6H7O7
B. X不能发生消去反应,但能发生水解反应
C. 1mol物质X最多可以和4molNaOH发生反应
D. 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制0.2mol/L 的NaOH溶液980mL,有以下仪器:
①烧杯 ②100mL量筒 ③托盘天平(带砝码) ④玻璃棒 ⑤胶头滴管
(1)配制时,必须使用的仪器有___________(填代号),还缺少的玻璃仪器是 ________。该实验中两次用到玻璃棒,其作用分别是_______________,_________________。
(2)使用容量瓶前必须进行的一步操作是_____________________。
(3)配制溶液时,一般可以分为以下几个步骤:正确的操作顺序是:_______________(用字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的NaOH固体的质量,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入1000mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
在①操作中需称量NaOH_______g
(4)请你分析下列哪些操作会引起所配浓度偏大(填写字母)___________________。
A.将NaOH放在滤纸上称量
B.称取NaOH的砝码已生锈
C.容量瓶未干燥即用来配制溶液
D.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
E.往容量瓶转移时,有少量液体溅出
F.在容量瓶中定容时视线如下图所示

G.烧杯未进行洗涤
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(5)若定容时不小心使液面超过了刻度线,应采取的措施是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下图是元素周期表中的一格,从中获取的信息不正确的是( )

A. 该元素的元素符号为Ar
B. 该元素属于金属元素
C. 该元素的原子核外有18个电子
D. 该元素的相对原子质量为39.95
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)在25℃、101kPa下,1gCH3OH(l)燃烧生成CO2(g)和H2O(l)时放热22.68kJ。则CH3OH燃烧的热化学方程式为_________________________。
(2)若以(1)中反应原理设计成甲醇燃料电池,电解质溶液为20%~30%的 KOH溶液,则该燃料电池的负极电极反应式为_________________________。
(3)将pH=3的CH3COOH溶液稀释100倍后,溶液的pH范围是____________;将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液显____性(填“酸”、“碱”或“中”)
(4)某温度下,反应2NH3(g)![]() N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。若某时刻向该容器内通入一定量氨气,则化学平衡________移动(填“正向”、“逆向”或“不”)。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动(填“正向”、“逆向”或“不”)。
N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。若某时刻向该容器内通入一定量氨气,则化学平衡________移动(填“正向”、“逆向”或“不”)。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如图,下列关于TPE的说法正确的是

A. TPE属于苯的同系物
B. TPE能发生加成反应,但不能取代反应
C. TPE与化合物 互为同分异构体
互为同分异构体
D. TPE的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁块,放置一段时间。下列有关描述正确的是
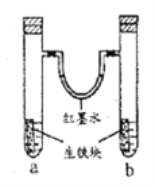
A. 生铁块中的碳是原电池的负极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe-2e-=Fe2+
D. a试管中发生了析氢腐蚀,b试管中发生了吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2=S4O62-+2I-
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)

实验步骤:
(1)按如图所示组装好装置后,应先_______________(填操作名称),再按图示加入试剂。仪器B和D的作用是____________________________;E中的试剂是__________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为______________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择):
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)用I2的标准溶液测定产品的纯度
取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除__________及二氧化碳。取10.00mL溶液。以________溶液为指示剂,用浓度为0.10mol/LI2的标准溶波进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________________________。Na2S2O3·5H2O在产品中的质量分数是_______________(用百分数表示,且保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com