
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
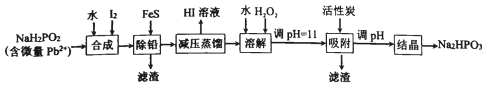
请回答:
(1)“合成”过程,主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为______________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为_____________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用为__________。
(5)工业上常用电解Na2HPO3溶液制备亚磷酸,其装置示意图:
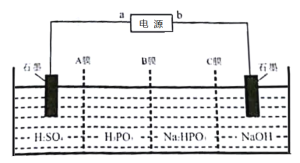
①a为电源______(填“正极”或“负极”)。
②B膜应选择___________(填“阴离子”“质子”或“阳离子”)交换膜。
③阳极的电极反应式为____________。
【答案】NaH2PO2+I2+H2O=H3PO3+NaI+HI FeS(s)+Pb2+(aq)=PbS(s)+Fe2+(aq) NaH2PO3 除铁、将NaH2PO3转换为Na2HPO3 正极 阴离子 2H2O-4e-=O2↑+4H+
【解析】
“合成”步骤,NaH2PO2和I2和水反应生成H3PO3和NaI和HI;之后加入FeS将Pb2+转化为PbS除去,此时溶液中的杂质为Fe2+;因为HI易挥发,“减压蒸馏”获得HI溶液,剩余固体主要为含有Fe2+杂质的NaH2PO3,加水溶解,再加入H2O2将Fe2+氧化成Fe3+,调pH=11将Fe3+转化为沉淀除去,同时部分NaH2PO3转换为了Na2HPO3;再次调pH将NaH2PO3彻底转化为Na2HPO3,最后“结晶”得到Na2HPO3固体,据此分析解答;
(5)电解的目的是利用Na2HPO3溶液制备亚磷酸,所以电解过程中Na2HPO3溶液中的HPO![]() 需要向左移动,电解池中阴离子流向阳极,所以左侧为电解池阳极,a为电源正极,b为电源负极。
需要向左移动,电解池中阴离子流向阳极,所以左侧为电解池阳极,a为电源正极,b为电源负极。
(1)根据后续流程可知“合成”步骤中产生HI,说明I2将NaH2PO2氧化,HI为强酸,所以还生成H3PO3和NaI,根据电子守恒和元素守恒可得该反应的化学方程式为:NaH2PO2+I2+H2O= H3PO3+NaI+HI;
(2)“除铅”过程,利用沉淀转化原理,加入FeS将Pb2+变成PbS,离子方程式为:FeS(s)+Pb2+(aq)=Fe2+(aq)+PbS(s);
(3)根据合成步骤的反应,可知蒸馏前溶液中主要含H3PO3、NaI和HI,而蒸馏过程I-回收率为95%,说明H3PO3和NaI反应有NaH2PO3生成,则剩余固体的主要成分为NaH2PO3;
(4)“调pH=11”的作用:将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3;
(5)①根据分析可知a为电源正极;
②电解过程中HPO![]() 需要穿过B膜,所以B膜应选择阴离子交换膜;
需要穿过B膜,所以B膜应选择阴离子交换膜;
③左侧与电源正极相连为阳极,阳极为硫酸溶液,水电离出的氢氧根放电生成氧气,电极反应式为2H2O-4e-=O2↑+4H+。


科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种固定CO2的电化学装置如图,该电化学装置放电时可将CO2转化为Li2CO3和C,充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法正确的是

A.放电时,Li+向电极X方向移动
B.充电时,电极Y应与外接直流电源的负极相连
C.充电时,阳极的电极反应式为C +2Li2CO3-4e- =3CO2 ↑+4Li +
D.充电时,每转移0.4mol电子,理论上阳极生成标准状况下4.48LCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。下列说法正确的是( )
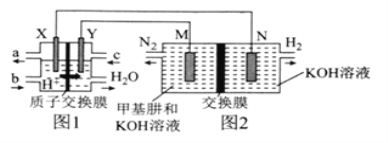
A.M极的电极反应式为CH3—NH—NH2+12OH--10e-=CO![]() +N2↑+9H2O
+N2↑+9H2O
B.图1中电解质溶液的pH减小,图2中电解质溶液的pH增大
C.图2中的交换膜是阴离子交换膜,OH-透过交换膜向N极移动
D.理论上,当生成6.72LH2时,消耗CH3OCH3的质量为2.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子。请回答下列问题:
(1)B原子最高能级有___个单电子。D原子的价电子排布图为___。
(2)B与C形成的四原子阴离子,其中心原子的杂化方式为__。
(3)C3分子的立体构型为__;与其互为等电子体的分子有__,离子有__。
(4)A、B、C、D四种元素简单氢化物沸点由高到低的顺序是___。(用化学式表示)
(5)F在元素周期表中位于__区,F的晶体中原子的堆积方式是图中的__(填写“甲、乙或丙”),其配位数为__。

(6)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式___。
(7)CaTiO3的晶胞为立方晶胞,结构如图丁所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)晶体的密度为ρg/cm3,Ca2+位于O2-构成的正八面体的体心位置,则该正八面体的边长为___nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
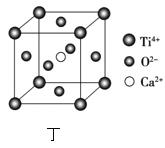
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁俗称为磁性氧化铁,通常用作颜料、抛光剂和电讯器材等。某化学兴趣小组取磁性氧化铁进行铝热反应实验并对产物进行探究。

(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是__________。
(2)取少许反应生成的“铁块”溶于盐酸,滴加硫氰化钾溶液后溶液不变红,则______(填“能”或“不能”)说明“铁块”一定不含四氧化三铁,理由是_________。
(3)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝,该实验所用的试剂是__________,反应的离子方程式为___________。
(4)请写出此铝热反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
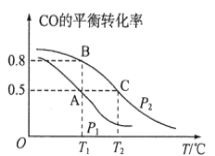
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________________。
③下列叙述能说明上述反应能达到化学平衡状态的是__________________(填代号) 。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=__________________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大,不变或减小”)。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol。此时v(正)________v(逆)(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①用50mL 0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称__,另一处错误是____。

②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择___molL-1的溶液进行实验。大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)。
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会____;(填“偏大、偏小、无影响”)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L的NaOH溶液所求中和热____(填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水中的电离方程式书写正确的是( )
A.H2CO3![]() 2H++CO32-B.Al(OH)3=Al3+ +3OH-
2H++CO32-B.Al(OH)3=Al3+ +3OH-
C.NH3·H2O![]() NH4+ +OH-D.NaHSO4=Na++HSO4-
NH4+ +OH-D.NaHSO4=Na++HSO4-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com