
【题目】四氧化三铁俗称为磁性氧化铁,通常用作颜料、抛光剂和电讯器材等。某化学兴趣小组取磁性氧化铁进行铝热反应实验并对产物进行探究。

(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是__________。
(2)取少许反应生成的“铁块”溶于盐酸,滴加硫氰化钾溶液后溶液不变红,则______(填“能”或“不能”)说明“铁块”一定不含四氧化三铁,理由是_________。
(3)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝,该实验所用的试剂是__________,反应的离子方程式为___________。
(4)请写出此铝热反应的化学方程式:_____________。
【答案】铺上氯酸钾,插镁条并将其点燃 不能 产物中生成的铁和可能未反应完的铝能还原溶液中的铁离子,所以溶液不变红,因而不能说明“铁块”一定不含四氧化三铁 氢氧化钠溶液 2Al+2OH-+2H2O=2![]() +3H2↑ 8Al+3Fe3O4
+3H2↑ 8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
【解析】
(1)铝热反应的引发:铝热剂上铺KClO3,插镁条并将其点燃即可;
(2)铁单质能把铁离子还原为亚铁离子;
(3)金属铁和氢氧化钠不反应,但金属铝可以和氢氧化钠反应放出氢气;
(4)四氧化三铁和铝反应生成铁和氧化铝。
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是:铝热剂上铺上氯酸钾,插镁条并将其点燃。
(2)取少许反应生成的“铁块”溶于盐酸,滴加硫氰化钾溶液后溶液不变红,不能说明“铁块”一定不含四氧化三铁 ,理由是:产物中的铁单质和可能未反应完的铝能还原溶液中的铁离子,所以溶液不变红,因而不能说明“铁块”一定不含四氧化三铁。
(3)证明上述所得的“铁块”中含有金属铝简单的实验方案是用氢氧化钠溶液,取该铁块,向其中加入氢氧化钠溶液,若固体溶解,同时产生无色无味的气体,则证明含有铝,反应的离子方程式是2Al+2OH-+2H2O=2![]() +3H2↑。
+3H2↑。
(4)在高温下,铝与四氧化三铁发生铝热反应,生成氧化铝和铁,反应方程式是8Al+3Fe3O4![]() 4Al2O3+9Fe。
4Al2O3+9Fe。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A. 2 g H2含有的氢原子数目为NA
B. 1 L 1molL﹣1KOH溶液中含有的钾离子数目为NA
C. 1 mol Zn完全变为Zn2+失去的电子数目为NA
D. 常温常压下,22.4 LO2含有的分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:
(1)已知下列热化学方程式:
i. CH2=CHCH3(g)+ Cl2(g)=CH2ClCHClCH3(g) △H1= -133 kJ·mol-1
ii. CH2=CHCH3(g)+Cl2(g)=CH2 =CHCH2Cl(g)+HCl(g) △H2= -100 kJ·mol-1
又已知在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g) 的正反应的活化能Ea(正)为132 kJmol-1,则逆反应的活化能Ea(逆)为________kJmol-1。
(2)查阅资料得知,反应CH3CHO(aq)=CH4(g)+CO(g)在含有少量I2的溶液中分两步进行:
第I步反应为CH3CHO(aq)+I2(aq)→CH3I(l) +HI(aq)+CO(g)(慢反应);
第II步为快反应。增大I2的浓度________(填“能”或“ 不能”)明显增大总反应的平均速率,理由为______________。
(3)用催化剂Fe3(CO)12/ZSM -5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。

欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM -5中添加__________助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是__________________。
(4)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4) =2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:
CS2(g)+4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:

为提高H2S的平衡转化率,除改变温度外,还可采取的措施是______________(列举一条)。N点对应温度下,该反应的Kp=______ ( MPa)2(Kp为以分压表示的平衡常数)。
(5)合成碳酸二甲酯的工作原理如下图所示。

阳极的电极反应式为_______,离子交换膜a为__________(填“阳膜”、“阴膜”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容下使NH2COONH4 (s)![]() 2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
A.V正(NH3) =2V逆(CO2)
B.密闭容器中氨气的体积分数不变
C.密闭容器中总压强不变
D.密闭容器中混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
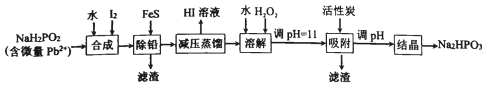
请回答:
(1)“合成”过程,主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为______________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为_____________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用为__________。
(5)工业上常用电解Na2HPO3溶液制备亚磷酸,其装置示意图:
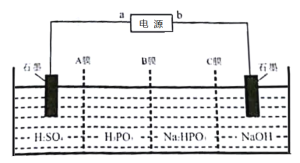
①a为电源______(填“正极”或“负极”)。
②B膜应选择___________(填“阴离子”“质子”或“阳离子”)交换膜。
③阳极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体。并将A、B、C按如图所示装置连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
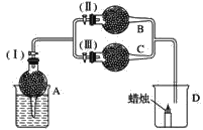
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是______________。
(2)在装置B中的淡黄色粉末是______________。
(3)在干燥管C中的白色固体应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA)是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期在医学上使用,作手术缝合线及骨钉等,现在则已较广泛应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出的淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米秸秆、麦秆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为___________________________________________。
(2)已知1 mol葡萄糖![]() 2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8 g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
②另取1.8 g乳酸与过量的金属钠反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
由实验数据推知乳酸分子含有________(填官能团名称),从以上条件推知乳酸的结构简式可能为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com