
【题目】一种固定CO2的电化学装置如图,该电化学装置放电时可将CO2转化为Li2CO3和C,充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法正确的是

A.放电时,Li+向电极X方向移动
B.充电时,电极Y应与外接直流电源的负极相连
C.充电时,阳极的电极反应式为C +2Li2CO3-4e- =3CO2 ↑+4Li +
D.充电时,每转移0.4mol电子,理论上阳极生成标准状况下4.48LCO2
【答案】D
【解析】
根据题干分析可知,放电时,X极上Li失电子,则X为负极,Y为正极,正极上CO2得电子生成C和Li2CO3;充电时,阴极上Li+得电子生成Li,阳极上Li2CO3发生氧化反应,释放出CO2和O2,电极反应式为2Li2CO3-4e-==2CO2↑+4Li++O2↑,据此分析解答。
A.放电时,X极上Li失电子,则X为负极,Y为正极,阳离子向正极移动,即Li+向电极Y方向移动,A选项错误;
B.该电池充电时,电源的负极与外加电源的负极相连,即电极X与外接直流电源的负极相连,B选项错误;
C.阳极上Li2CO3发生氧化反应,释放出CO2和O2,电极反应式为2Li2CO3-4e-==2CO2↑+4Li++ O2↑,C选项错误;
D.电池充电时,只有Li2CO3发生氧化反应,所以反应式为2Li2CO3-4e-==2CO2↑+4Li++O2↑每转移0.4mol电子,理论上阳极产生0.2molCO2,标准状况下的体积为4.48L,D选项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】医学上经常用硫酸亚铁糖衣片给这种贫血病人补铁。现取20粒糖衣片,质量为10g,溶于40g水中,向所配溶液中滴加氢氧化钠溶液至略过量过滤、洗涤、干燥,然后进行灼烧到固体质量不再发生改变,质量为0.8g。试计算:
(1)该糖衣片中硫酸亚铁的质量分数______。
(2)1粒糖衣片中含铁元素的质量______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,A的溶解度是Sg·100g-1,其饱和溶液密度为dg·cm-3、物质的量浓度为cmol·L-1。溶液的质量分数为w,A的摩尔质量为Mg·mol-1,实验测得向一定量含A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:Ksp[ Al(OH)3]=1.0×10-34 Ksp[Fe(OH)3]=4.0×10 -38。已知::“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子,该离子会水解,下列说法不正确的是
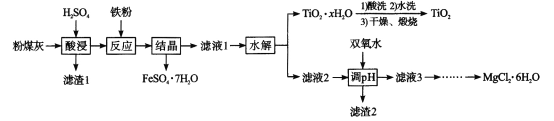
A.“酸浸”时TiO2发生反应的离子方程式为TiO2 +2H+= =TiO2+ +H2O
B.“结晶”时温度需控制在70℃以上,温度过低TiO2![]() xH2O产率降低
xH2O产率降低
C.为使滤渣2沉淀完全,需“调pH"最小为4.3
D.MgCl2溶液制备MgCl2![]() 6H2O需要在HCl的气氛下蒸发浓缩
6H2O需要在HCl的气氛下蒸发浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③NaOH(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3
A.①③
B.②③
C.②④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:
(1)已知下列热化学方程式:
i. CH2=CHCH3(g)+ Cl2(g)=CH2ClCHClCH3(g) △H1= -133 kJ·mol-1
ii. CH2=CHCH3(g)+Cl2(g)=CH2 =CHCH2Cl(g)+HCl(g) △H2= -100 kJ·mol-1
又已知在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g) 的正反应的活化能Ea(正)为132 kJmol-1,则逆反应的活化能Ea(逆)为________kJmol-1。
(2)查阅资料得知,反应CH3CHO(aq)=CH4(g)+CO(g)在含有少量I2的溶液中分两步进行:
第I步反应为CH3CHO(aq)+I2(aq)→CH3I(l) +HI(aq)+CO(g)(慢反应);
第II步为快反应。增大I2的浓度________(填“能”或“ 不能”)明显增大总反应的平均速率,理由为______________。
(3)用催化剂Fe3(CO)12/ZSM -5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。

欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM -5中添加__________助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是__________________。
(4)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4) =2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:
CS2(g)+4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:

为提高H2S的平衡转化率,除改变温度外,还可采取的措施是______________(列举一条)。N点对应温度下,该反应的Kp=______ ( MPa)2(Kp为以分压表示的平衡常数)。
(5)合成碳酸二甲酯的工作原理如下图所示。

阳极的电极反应式为_______,离子交换膜a为__________(填“阳膜”、“阴膜”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如图:
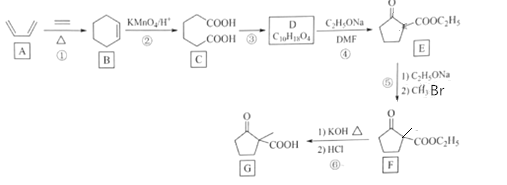
已知:R1CH2COOCH2CH3+R2COOCH2CH3![]() +CH3CH2OH
+CH3CH2OH
(1)化合物A的名称是__。
(2)反应②和⑤的反应类型分别是__、__。
(3)写出C到D的反应方程式__。
(4)E的分子式__。
(5)F中官能团的名称是__。
(6)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四组峰,且峰面积之比为6:2:1:1。写出两种符合要求的X的结构简式___。
(7)设计由乙酸乙酯和1,4-二溴丁烷制备 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
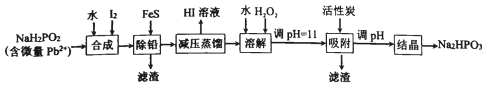
请回答:
(1)“合成”过程,主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为______________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为_____________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用为__________。
(5)工业上常用电解Na2HPO3溶液制备亚磷酸,其装置示意图:
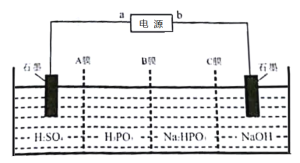
①a为电源______(填“正极”或“负极”)。
②B膜应选择___________(填“阴离子”“质子”或“阳离子”)交换膜。
③阳极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com