
【题目】①用50mL 0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称__,另一处错误是____。

②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择___molL-1的溶液进行实验。大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)。
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会____;(填“偏大、偏小、无影响”)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L的NaOH溶液所求中和热____(填“相等、不相等”)。
【答案】环形玻璃搅拌棒 小烧杯口和大烧杯口没有平齐 0.55 偏小 偏小 相等
【解析】
①根据装置图及实验步骤,确定缺少的仪器及错误之处;
②根据Q=cmt及H=-Q/n分析操作对中和热的影响。
①根据装置图,缺少的仪器为环形玻璃搅拌棒;有一处错误为大、小烧杯上沿未齐,大、小烧杯上沿齐平时,可减少气体产生对流,减小热量损失;
②为了使盐酸充分反应,减少误差,则使用稍过量的NaOH溶液,应选用0.55mol/L的NaOH溶液;大烧杯上如不盖硬纸板,热量损失较多,计算出的中和热数值偏小;
③用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液时,醋酸为弱电解质,电离时吸收热量,导致中和热的数值偏小;用60mL 0.50mol/L盐酸与50mL 0.55mol/L的NaOH溶液时,放出的热量增大,生成的水也增大,中和热的焓变不变。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:Ksp[ Al(OH)3]=1.0×10-34 Ksp[Fe(OH)3]=4.0×10 -38。已知::“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子,该离子会水解,下列说法不正确的是
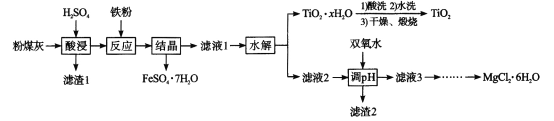
A.“酸浸”时TiO2发生反应的离子方程式为TiO2 +2H+= =TiO2+ +H2O
B.“结晶”时温度需控制在70℃以上,温度过低TiO2![]() xH2O产率降低
xH2O产率降低
C.为使滤渣2沉淀完全,需“调pH"最小为4.3
D.MgCl2溶液制备MgCl2![]() 6H2O需要在HCl的气氛下蒸发浓缩
6H2O需要在HCl的气氛下蒸发浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
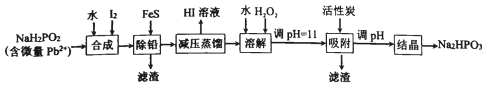
请回答:
(1)“合成”过程,主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为______________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为_____________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用为__________。
(5)工业上常用电解Na2HPO3溶液制备亚磷酸,其装置示意图:
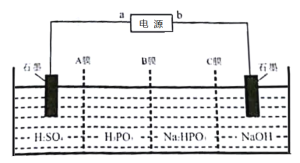
①a为电源______(填“正极”或“负极”)。
②B膜应选择___________(填“阴离子”“质子”或“阳离子”)交换膜。
③阳极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA)是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期在医学上使用,作手术缝合线及骨钉等,现在则已较广泛应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出的淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米秸秆、麦秆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为___________________________________________。
(2)已知1 mol葡萄糖![]() 2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8 g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
②另取1.8 g乳酸与过量的金属钠反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
由实验数据推知乳酸分子含有________(填官能团名称),从以上条件推知乳酸的结构简式可能为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是分解反应的产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
D.饱和溶液一定比不饱和溶液的浓度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有NaClO3、KCl、NaOH、ZnSO4、NaAl(OH)4和NaNO2中的几种,进行如下实验:①X溶于水,得到溶液Y;②溶液Y先加入过量稀HNO3酸化,再加入AgNO3溶液,得到白色沉淀W,下列说法不正确的是( )
A.混合物X中可能含有KCl
B.向溶液Y中滴加盐酸,若产生白色沉淀,说明X中一定含有NaAl(OH)4
C.向溶液Y中滴加盐酸,若产生红棕色的气体,说明X中一定含有NaNO2
D.取X溶液进行焰色反应,透过蓝色钴玻璃片没有观察到紫色火焰,说明X中一定含有NaClO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com