
【题目】[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为____ ,基态Cu3+的核外电子排布式为_ _______。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A.V2O5 | B.CrO2 | C.PbO | D.ZnO |
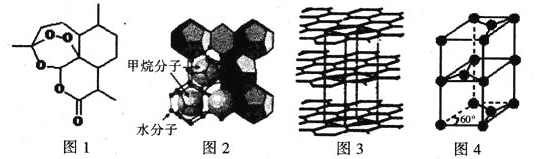
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为 ;碳原子的杂化方式有____ 。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为 。
②H2O的VSEPR模型为 ,比较键角的大小:H2O CH4(填“>”“<”或“=”),原因为 。
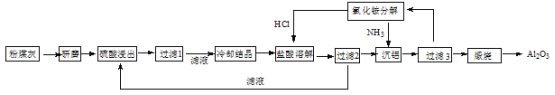
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有 个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为 g·cm-3(列出计算式)。
【答案】(1)第四周期第ⅠB族 [Ar] 3d8
(2)B
(3)O>C>H sp2、sp3(共1分,有错或不全均不得分`.)
(4)①氢键、范德华力②四面体形 < 甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小。(1分,答案合理即可得分)
(5)4,![]() 或
或![]() 或
或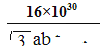
【解析】试题分析:(1)据元素周期表得,铜在周期表中位于:第四周期第ⅠB族;铜是29号元素故Cu3+的核外电子排布式为:[Ar] 3d8。(2)四价Cr核外有未成对电子故有磁性,答案选B。(3)由图1得,组成元素是CHO三种元素,故其电负性由大到小的顺序为:O>C>H;其中碳原子存在双键和单键故为sp2、sp3杂化。(4)①可燃冰中存在水,故有氢键,分子之间存在范德华力;②水分子中价层电子对个数=2+1/2×(6-2×1)=4且含有2个孤电子对,所以其空间构型为四面体结构;甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小,故H20<CH4。(5)中间四个顶点代表的原子被四个相邻的晶胞所共享,这样每个晶胞中只分摊到0.25个原子,一个晶胞中含有碳原子数=0.25*4=1,上层和下层八个顶点各属于八个晶胞每个晶胞只分摊到1/8,一个晶胞中含有碳原子数=1/8/*8=1,体心上一个,上下面上各占半个共1个,故一个晶胞中含有碳原子数4个碳原子;密度=质量/体积=![]() =
=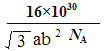 。
。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为:SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
(1)粉煤灰研磨的目的是 。
(2)第1次过滤滤渣的主要成分有 和 (填化学式, 下同),第3次过滤时,滤渣的成分的是 。
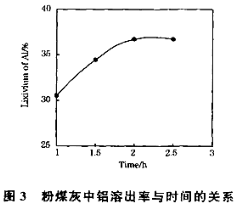
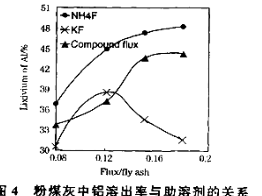
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如下图1,适宜的浸取时间为 h;铝的浸取率与“助溶剂/粉煤灰”的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及其NH4F与KF的混合物,在助溶剂/粉煤灰相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂缺点是 (举一例)。
(4)流程中循环使用的物质有 和 (填化学式)。
(5)用盐酸溶解硫酸铝晶体,能够发生的原因是 。
(6)用粉煤灰制取含铝化合物的主要意义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:
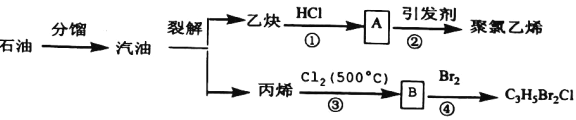
(1)写出反应②的化学方程式__________。
(2)B分子中无甲基,则B的结构简式为__________。系统命名为__________。
(3)反应①和③的类型依次是__________、__________。
(4)写出反应③化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
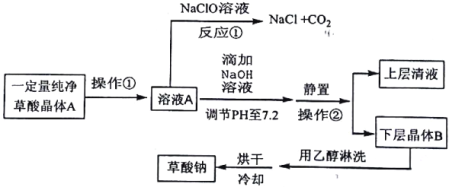
【题目】某化学小组为探究草酸的性质并制备草酸钠及其用途,查阅到如下信息:

探究草酸部分性质并制备草酸钠的生产流程如下:
请回答下列问题:
(1)写出反应①的化学方程式__________。表明草酸具有__________性。
(2)向溶液A中加入NaOH溶液,开始滴加速度要尽量快些.其目的是__________。该反应达到终点时的化学方程式为__________。
(3)操作②的名称是__________。用乙醇淋洗晶体B的目的是__________
(4)用0.01000mol/L的高锰酸钾溶液滴定25.00mL某浓度的草酸钠溶液时.需要加入适量的稀硫酸,所发生反应为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,若硫酸加入太多,结果会__________:操作中需用__________滴定管(填“酸式”或“碱式”),当达到反应终点时的现象是__________;测得此时消耗上述高锰酸钾溶液20.00mL,则该草酸钠溶液浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01molNH4Cl和0.002molNaOH溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示:
①____________
②____________
③____________。
(2)溶液中含有的微粒是__________________。
(3)在上述溶液中,电荷守恒是:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据反应Fe+H2SO4=FeSO4+ H2↑ 回答下列问题。
(1)在此反应中,自反应开始至2分钟末,H2SO4浓度由1mol/L变为0.4mol/L,则H2SO4的反应速率为 。若要使该反应的反应速率加快,下列措施不可行的是 (填字母)
a、改铁片为铁粉 b、改稀H2SO4为98%的浓H2SO4
c、升高温度 d、滴加少量CuSO4溶液
(2)在答题卡的坐标图中,画出此反应过程中体系的能量变化图(进行必要的标注)
(3)根据此反应设计一个原电池,要求画出装置图并进行必要的标注
Ⅱ.某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。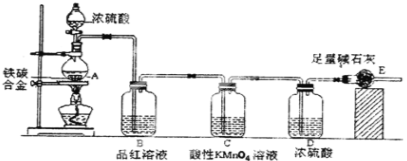
(1)将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,加热,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为____________(写表达式)。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
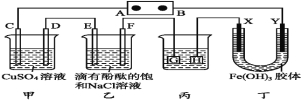
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应是 ,电镀液是 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
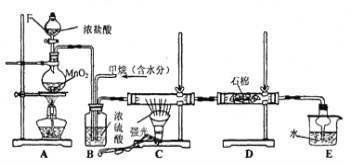
【题目】利用甲烷与氯气发生反应制取盐酸的设想,在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
根据要求填空:
(1)装置A中反应的离子方程式为 ;
(2)B装置有三种功能:
①控制气流速度;② ;③ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(4)D装置中的石棉上均匀附着湿润的KI粉末,其作用是 ,
E装置的作用是 。
(5)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 ;
该装置还有缺陷,原因是没有进行尾气处理,写出尾气中的主要成分是 。
(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
(6)实验之余,该学习小组进一步探究甲烷与氯气反应的条件。

通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)混合气体(I、II),II瓶用预先准备好的黑色纸套套上,I瓶放在光亮处(不要放在日光直射的地方,以免引起爆炸)。按上图安装好装置,并夹紧弹簧夹a和b。过一段时间,打开弹簧夹a、b,I、II中观察到现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
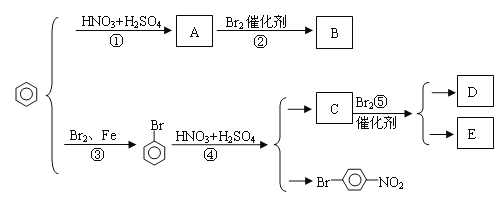
【题目】苯环上原有的取代基对新取代导入苯环上的取代基的位置有一定的影响,其规律是(1)苯环上新导入的取代基所占的位置主要决定于原有取代基的性质;(2)可以把原有取代基分成两类:第一类取代基主要使新导入的取代基进入苯环的邻位和对位,如—OH、—CH3(或烃基)、—Cl、—Br、—O—COR等。第二类取代基主要使新导入的取代基进入苯环的间位,如—NO2、—SO3H、—CHO等。请写出下图中②④⑤三步反应的化学方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com