
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如图所示。(提示:Na[Al(OH)4]+HCl→Al(OH)3↓+NaCl+H2O)
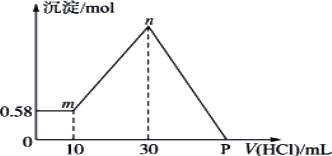
(1)混合物中NaOH的质量是________g;AlCl3的质量是________g;MgCl2的质量是________g。
(2)P点所表示盐酸加入体积是________ mL。
【答案】2.6 1.335 0.95 130
【解析】
(1)n点溶液中存在的溶质是氯化钠,根据原子守恒可知n(NaOH)=n(NaCl),则原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl);生成氢氧化铝沉淀消耗20mL盐酸,根据方程式计算Al(OH)3的物质的量,再根据Al原子守恒计算n(AlCl3),并求其质量;由图可知,氢氧化镁的质量为0.58g,根据镁原子守恒计算n(MgCl2),并求其质量;
(2)P点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知m(NaOH)=n(NaCl),进而计算加入盐酸的体积。
(1)n点溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol,故NaOH的质量为0.065mol×40g/mol=2.6g,由[Al(OH)4]-+H+=Al(OH)3↓+H2O,则n[Al(OH)3]=n(HCl)=0.5mol/L×(0.03-0.01)L=0.01mol,根据铝原子守恒得n(AlCl3)=n[Al(OH)3]=0.01mol,故AlCl3的质量是0.01mol×133.5g/mol=1.335g;由图可知,氢氧化镁的质量为0.58g,其物质的量为![]() =0.01mol,根据镁原子守恒:n(MgCl2)=n[Mg(OH)2]=0.01mol,故MgCl2的质量是0.01mol×95g/mol=0.95g;
=0.01mol,根据镁原子守恒:n(MgCl2)=n[Mg(OH)2]=0.01mol,故MgCl2的质量是0.01mol×95g/mol=0.95g;
(2)P点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知m(NaOH)=n(NaCl)=0.065mol,C点加入盐酸的体积为![]() =0.13L=130mL。
=0.13L=130mL。


科目:高中化学 来源: 题型:
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室某硫酸试剂瓶标签上的部分内容,据此下列说法正确的是( )

A.该硫酸的物质的量浓度为9.2mol/L
B.该硫酸与等体积的水混合所得溶液的质量分数等于49%
C.配制500mL4.6mol/L的稀硫酸需取该硫酸125.0mL
D.1molFe与足量的稀硫酸反应,标准状况下产生44.8L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:

(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某无色溶液中只含有下列7种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-,已知该溶液与铝反应放出氢气,若反应后生成AlO2-,则溶液中一定存在的离子有______________,一定不存在的离子有______________,可能存在的离子有__________________,该溶液与铝反应放出氢气的离子方程式为_____________________________________。
(2)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,某兴趣小组首先将其制成水溶液。
①通常将氢氧化钠溶液加入氯化亚铁溶液的实验现象是___,
②书写氢氧化亚铁在空气中转化为氢氧化铁的化学方程式___。
(3)在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是___。试解释原因:___。有同学提出加入CuO以除去Fe3+。你认为理由是___。
(4)能不能直接蒸发CuCl2溶液得到CuCl2·2H2O晶体?___(填“能”或“不能”)。若能,不用回答;若不能,说明理由___。
(5)将FeCl3固体溶于蒸馏水配制溶液时常会出现浑浊,得不到澄清的氯化铁溶液,其原因是___,如果要得到澄清的氯化铁溶液,可采取的措施是___。
(6)泡沫灭火器使用NaHCO3和Al(SO4)3溶液反应产生CO2来灭火。试从平衡移动的角度分析以上两种溶液反应产生CO2的原因:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是____(填元素编号)。d、e、f三种元素的原子结构上的相同点是___。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是____;六种元素中,最高价氧化物对应水化物的酸性最强的是____(填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_____(选填“强”、“弱’’)。
(4)若b为非金属元素,则以下推断正确的是____(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用氢氧化钠固体配制1.0mol·L-1的氢氧化钠溶液240mL:
(1)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、____________。
(2)计算实验需要称量氢氧化钠的质量为:___________ g
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
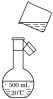
①________________________________________________________________________;
②________________________________________________________________________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是______(填字母)。
A.所用氢氧化钠已经潮解
B.向容量瓶中加水未到刻度线
C.有少量氢氧化钠溶液残留在烧杯里
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四大基本反应类型,但属于氧化还原反应的是
A. 2Na+2H2O===2NaOH+H2↑
B. Cl2+H2O===HCl+HClO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. Ca(ClO)2+2HCl===CaCl2+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com