
【题目】实验室欲用氢氧化钠固体配制1.0mol·L-1的氢氧化钠溶液240mL:
(1)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、____________。
(2)计算实验需要称量氢氧化钠的质量为:___________ g
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
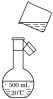
①________________________________________________________________________;
②________________________________________________________________________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是______(填字母)。
A.所用氢氧化钠已经潮解
B.向容量瓶中加水未到刻度线
C.有少量氢氧化钠溶液残留在烧杯里
【答案】250ml 容量瓶、玻璃棒 10.0 检查容量瓶是否漏液 容量瓶的规格选错 未用玻璃棒引流 B
【解析】
(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,根据操作步骤选择仪器;
(2)根据m=cVM计算氢氧化钠的质量;
(3)根据容量瓶的使用方法回答;
(4)应选用250mL的容量瓶,移液时用玻璃棒引流;
(5)根据![]() 分析误差。
分析误差。
没有240mL容量瓶,应选择250mL容量瓶,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,定容后颠倒摇匀,所以需要的玻璃仪器有烧杯、胶头滴管、250mL容量瓶、玻璃棒。
(2)实验选择250mL容量瓶,所以需氢氧化钠的质量为m=0.25L×1molL-1×40g/mol=10.0g;
(3)因为最后需颠倒摇匀,所以容量瓶在使用前必须检查是否漏水;
(4)应选用250mL的容量瓶,移液时用玻璃棒引流,根据图示,图中的错误有:①容量瓶的规格选错; ②未用玻璃棒引流;
(5)A.所用氢氧化钠已经潮解,则氢氧化钠物质的量偏小,所配溶液浓度偏低,故不选A;
B.向容量瓶中加水未到刻度线,溶液体积偏小,所配溶液浓度偏大,故选B;
C.有少量氢氧化钠溶液残留在烧杯里,氢氧化钠物质的量偏小,所配溶液浓度偏低,故不选C;


科目:高中化学 来源: 题型:
【题目】常温下,0.01mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1
C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如图所示。(提示:Na[Al(OH)4]+HCl→Al(OH)3↓+NaCl+H2O)
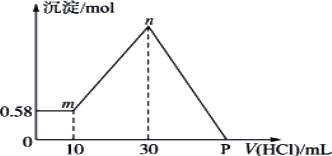
(1)混合物中NaOH的质量是________g;AlCl3的质量是________g;MgCl2的质量是________g。
(2)P点所表示盐酸加入体积是________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是
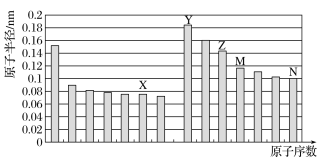
A.M在周期表中的位置为:第三周期,IV族
B.Y和N形成的化合物为离子化合物
C.X、N两种元素的气态氢化物的沸点相比,前者较低
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是
A | B | C | D | |
研究目的 | 温度(T)对反应的影响(T2>T1) | 压强(p)对平衡常数的影响 | 温度(T)对反应的影响 | 压强(p)对反应的影响(p2>p1) |
图示 |
|
|
|
|
A.AB.B .C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在2L恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平均反应速率为0.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ/mol。该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有____(填字母代号)。
2NH3(g) ΔH=92.4 kJ/mol。该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有____(填字母代号)。
a.增大压强 b.升高温度 c.增大N2浓度
d.及时移走生成物NH3 e.使用高效催化剂
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。
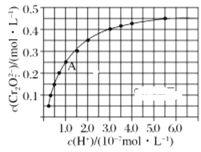
①用离子方程式表示Na2CrO4溶液中发生的转化反应____。
②由图可知,溶液酸性减弱,CrO42-的平衡转化率____(填“增大”、“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为____。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH___0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com