
【题目】“星型”聚合物具有独特的结构,在新兴技术领域有广泛的应用。下图是某“星型”聚合物的制备过程。
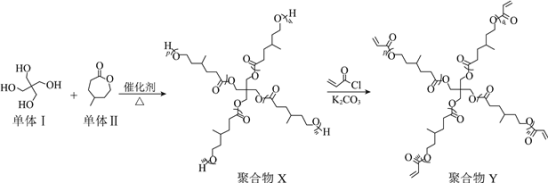
已知:![]()
下列说法不正确的是
A.单体Ⅰ的核磁共振氢谱有两组吸收峰,峰面积比为1∶2
B.单体Ⅰ与单体Ⅱ制备聚合物X,产物中有H2O
C.聚合物X转化为聚合物Y发生取代反应
D.聚合物Y可通过末端的碳碳双键交联形成网状结构
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,不是氧化还原反应的是 ( )
①H2+Cl2![]() 2HCl
2HCl
②Na2CO3+2HCl=2NaCl+H2O+CO2↑
③2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
④CuO+2HNO3=Cu(NO3)2+H2O
⑤2HgO![]() 2Hg+O2↑
2Hg+O2↑
A.②④B.①③C.①②③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧生成CO2气体可放出3147.9 kJ的热量,则下列热化学方程式正确的是( )
A. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ/mol
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ/mol
C. C+O2===CO2 ΔH=-393.49 kJ/mol
D. C(s)+![]() O2(g)===CO(g) ΔH=-393.49 kJ/mol
O2(g)===CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CuCl2为棕黄色固体,用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂等。实验室用如图所示装置制取CuCl2。(夹持装置省略)
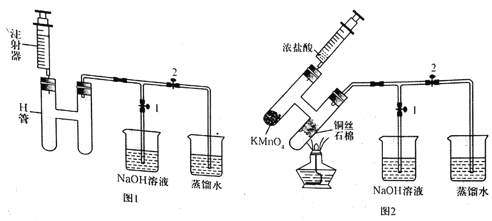
步骤1:制备时,首先按照图1所示连接实验装置。打开两处的止水夹,检验装置的气密性。
步骤2:用镊子向H管一端装入少量石棉,将其置于H管连通管以下部分且靠近连通管约![]() 处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
步骤3:关闭止水夹2,打开止水夹1,将H管如图2所示倾斜放置,点燃酒精灯,加热铜丝直至其呈红热状态。立即将浓盐酸注入H管使其与KMnO4发生反应(注意调整H管倾斜度以利于浓盐酸的加入),观察到有黄绿色气体通过连通管部分进入H管另一端,继而与热铜丝燃烧得到产物。
待反应结束后,等待一段时间再打开止水夹2,关闭止水夹1,拉动注射器将蒸馏水慢慢的吸入H管中,在H管底部得到CuCl2溶液。最后进行尾气的处理操作。请回答以下有关问题。
(1)检验图1所示装置气密性时的操作方法是______。反应过程中将H管倾斜放置的目的是_________(写出一条即可)。
(2)浓盐酸与KMnO4反应的化学方程式为______。热铜丝燃烧得到产物时,铜丝上方的H管中观察到的现象是_____。反应结束后,“等待一段时间”再进行后续操作的原因是______。
(3)实验观察到蒸馏水慢慢地吸入H管中时,H管底部得到CuCl2溶液的颜色,有一个从黄绿色到绿色再到蓝绿色的变化过程。已知在溶液中[Cu(H2O)4]2+呈蓝色,[CuCl4]2-呈黄色。请用方程式表示溶液颜色变化的化学平衡体系:___。
(4)H管中铜丝不直接放置在右管底部的优点是___(写出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类冶炼最多的金属元素是_______;请写出它与水在一定条件反应的化学方程式________熔点最低的金属是_________;导电性最好的金属是_________;人体内最多的金属元素是_________;海水中含量最多的金属元素是_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜由阳离子交换膜、催化剂层和阴离子交换膜组合而成,在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-,将其与阳离子交换膜(阳膜)、阴离子交换膜(阴膜)组合,可有多种应用。
(1)海水淡化:模拟海水淡化,双极膜组合电解装置示意图如下。

①X极是______极(填“阴”或“阳”)。
②电解后可获得较浓的盐酸和较浓的NaOH溶液,上图中双极膜的右侧得到的是______(填“H+”或“OH-”)。
(2)钠碱循环法脱除烟气中的SO2,并回收SO2:
用pH>8的Na2SO3溶液作吸收液,脱除烟气中的SO2,至pH<6时,吸收液的主要成分为NaHSO3,需再生。
Ⅰ.加热pH<6时的吸收液使其分解,回收SO2并再生吸收液。所得的再生吸收液对SO2的吸收率降低,结合离子方程式解释原因:______。
Ⅱ.双极膜和阴膜组合电渗析法处理pH<6时的吸收液,可直接获得再生吸收液和含较高浓度HSO3的溶液,装置示意图如下。

①再生吸收液从______室流出(填“A”或“B”)。
②简述含较高浓度HSO3的溶液的生成原理:______。
③与Ⅰ中的方法相比,Ⅱ中的优点是______(列出2条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴([Co(NH3)6]Cl3)是一种橙黄色晶体,实验室制备过程如下:
Ⅰ.将研细的6 g CoCl26H2O晶体和4 g NH4Cl固体加入锥形瓶中,加水,加热溶解,冷却;
Ⅱ.加入13.5 mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5 mL 5% H2O2溶液,水浴加热至50~60℃,保持20 min。用冰浴冷却,过滤,得粗产品;
Ⅲ.将粗产品溶于50 mL热的稀盐酸中,______,向滤液中缓慢加入6.7 mL浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤;
Ⅳ.先用冷的2 mol·L1 HCl溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
(1)[Co(NH3)6]Cl3中Co的化合价是______。
(2)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是______。
(3)溶液中CoCl2、NH4Cl和浓氨水混合后,与H2O2溶液反应生成[Co(NH3)6]Cl3的化学方程式是______。
(4)补全Ⅲ中的操作:______。
(5)沉淀滴定法测定制备的产品中Cl-的质量分数:
ⅰ.准确称取a g Ⅳ中的产品,配制成100 mL溶液,移取25 mL溶液于锥形瓶中;
ⅱ.滴加少量0.005 mol·L1 K2CrO4溶液作为指示剂,用c mol·L1 AgNO3溶液滴定至终点;
ⅲ.平行测定三次,消耗AgNO3溶液的体积的平均值为v mL,计算晶体中Cl-的质量分数。
已知:溶解度:AgCl 1.3×106 mol·L1,Ag2CrO4(砖红色)6.5×105 mol·L1
①ⅱ中,滴定至终点的现象是______。
②制备的晶体中Cl-的质量分数是______(列计算式,Cl的相对原子质量:35.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A.利用如图装置可制备Fe(OH)2
B.需要加热才能进行的化学反应一定是吸热反应
C.对铅蓄电池进形充电时,铅电极应连接外电源的正极
D.已知:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3 kJ·mol-1,若将1L 0.5mol·L-1盐酸与1L 0.55mol·L-1 NaOH的溶液混合,能放出28.65kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分被氧化的镁条1.6 g,和足量的盐酸反应,在标准状况下生成H21.12 L,在跟盐酸反应前被氧化的镁是 ( )
A.1.2 gB.0.64 gC.0.4 gD.0.24 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com