
【题目】人类冶炼最多的金属元素是_______;请写出它与水在一定条件反应的化学方程式________熔点最低的金属是_________;导电性最好的金属是_________;人体内最多的金属元素是_________;海水中含量最多的金属元素是_________.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取![]() 的绿色方法,原理如图所示(已知:
的绿色方法,原理如图所示(已知:![]() ,
,![]() )。下列说法错误的是( )
)。下列说法错误的是( )
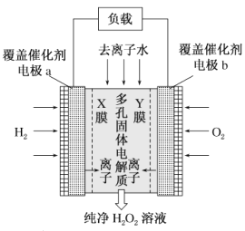
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成![]() 电极上流过
电极上流过![]()
D.b极上的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图利用培养皿探究氨气的性质,实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象的描述及所做的解释均正确的是
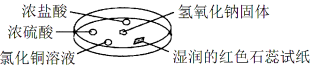
选项 | 实 验 现 象 | 解 释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化铜溶液变白色浑浊 | 白色浑浊的成分是Cu(OH)2 |
D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1,2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1,由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4 的反应。已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1,温度为T时,该反应的热化学方程式为__________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25 ℃,101 kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1 648 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1 2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1 480 kJ·mol-1,FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______。
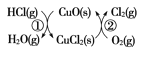
(4)用O2将HCl转化为Cl2,可提高效益,减少污染。 传统上该转化通过如图所示的催化循环实现,其中,反应①为:2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:

则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“星型”聚合物具有独特的结构,在新兴技术领域有广泛的应用。下图是某“星型”聚合物的制备过程。
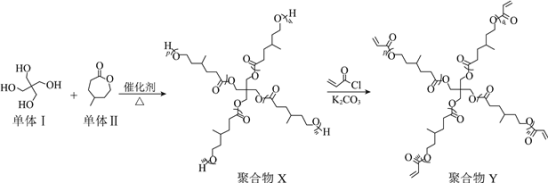
已知:![]()
下列说法不正确的是
A.单体Ⅰ的核磁共振氢谱有两组吸收峰,峰面积比为1∶2
B.单体Ⅰ与单体Ⅱ制备聚合物X,产物中有H2O
C.聚合物X转化为聚合物Y发生取代反应
D.聚合物Y可通过末端的碳碳双键交联形成网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入![]() 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为![]() 的
的![]() 溶液,生成的沉淀跟加入的
溶液,生成的沉淀跟加入的![]() 溶液的体积关系如图。(横坐标体积单位是
溶液的体积关系如图。(横坐标体积单位是![]() ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求:
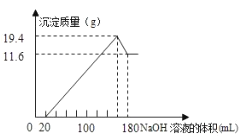
(1)合金中![]() ,
,![]() 的质量_____________
的质量_____________
(2)所用![]() 的物质的量浓度___________
的物质的量浓度___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(1)实验一:用如图所示装置制备并收集 NH3。
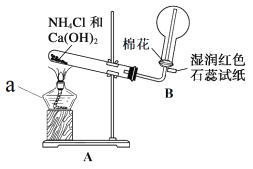
仪器 a 的名称为____________,装置 A 中产生 NH3 的化学方程式为____________, 装置 B 中用圆底烧瓶收集 NH3 的方法为____________(填“向上排空气法”或“向下 排空气法”),当湿润红色石蕊试纸颜色变为____________色,表示已经收集满 NH3。
(2)实验二:用如图所示装置进行 NH3 的喷泉实验。
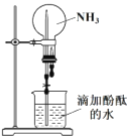
引发该喷泉实验的操作是先____________,再打开止水夹,使烧杯内的水通过导管进入烧瓶形成喷泉,说明 NH3 具有的物理性质是____________,烧瓶内溶液呈红色, 说明 NH3 的水溶液呈____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有CuO和Fe2O3组成的混合物ag,向其中加入2 molL﹣1的硫酸溶液50 mL,恰好完全反应。若将ag该混合物在足量H2中加热,使其充分反应,计算冷却后剩余固体质量_________。
(2)取一定量的CuO粉末与0.5 L稀硫酸充分反应后,将一根50 g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24 g。并收集到224 mL气体(标准状况)。求此CuO粉末的质量_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com