
【题目】实验室制取乙酸丁酯的实验装置有如图甲、乙两种装置可供选用。

制备乙酸丁酯所涉及的有关物质的物理性质见下表:

(1)制取乙酸丁酯的装置应选用 ______(填“甲”或“乙”),不选另一种装置的理由是 ______;
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)__________;
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
① ______________________________② ____________________________________;
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是__________________(选填答案编号)。

(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须 _____,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 ___________。
【答案】乙 由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发 CH3CH2CH2CH2OCH2CH2CH2CH3 CH3CH2CH=CH2 增加乙酸浓度 减小生成物浓度(或移走生成物) AB 检查是否漏水或堵塞,分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)
【解析】
(1)根据反应物乙酸、1-丁醇与生成物乙酸丁酯的沸点大小进行解答;
(2)在浓硫酸作用下,1-丁醇能够发生消去反应生成1-丁烯、能够发生分子内脱水生成正丁醚,据此写出副产物的结构简式;
(3)根据影响化学平衡的因素进行解答,提高1-丁醇转化率,可以增加另一种反应物浓度或者减少生成物浓度;
(4)提纯、分离乙酸丁酯,需要通过分液操作,不需要蒸发、过滤操作;
(5)分液漏斗有旋塞,实验前必须检查是否漏水或堵塞;若漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准,分液漏斗中的液体都不会流出。
(1)根据表中数据可知,反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发,大大降低了反应物的转化率,所以应该选用装置乙,故答案为:乙;由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发;
(2)1-丁醇在浓硫酸作用下能够发生消去反应生成1-丁烯,结构简式为:CH3CH2CH=CH2,也能够发生分子内脱水生成CH3CH2CH2CH2OCH2CH2CH2CH3,故答案为:CH3CH2CH2CH2OCH2CH2CH2CH3、CH3CH2CH=CH2;
(3)要提高1-丁醇的转化率,可以增大乙酸的浓度,使正反应速率增大,平衡向着正向移动;也可以减小生成物浓度,逆反应速率减小,平衡向着正向移动,故答案为:增加乙酸浓度;减小生成物浓度(或移走生成物);
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯,分离的是混合液体,不需要使用过滤、蒸发等操作,需要使用分液方法分离,所以一定使用的操作为AB,故答案为:AB;
(5)分液漏斗的下方有旋塞,使用前必须检查分液漏斗是否漏水或者是否堵塞;分液操作时,如果分液漏斗上口玻璃塞未打开,分液漏斗中的液体不会流出,故答案为:检查是否漏水或堵塞,分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. H2、I2、HI平衡混合气加压后颜色变深
C. 装有NO2的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酯的水解反应和酯化反应都属于取代反应
B.乙烯能使溴水褪色,发生氧化反应
C.乙醇不能被酸性高锰酸钾溶液氧化
D.葡萄糖不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)乙酸乙酯的键线式 _________________;间二甲苯的结构简式 ____________________;![]() 的分子式 ______________________;
的分子式 ______________________;
(2)戊烷(C5H12)的某种同分异构体只有一种一氯代物,该烃的结构简式: __________;
(3)分子式为C4H9Cl的物质,有4种同分异构体,请写出这4种同分异构体的结构简式:___________, __________, __________, _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下面结论正确的是
A. Pb为正极,被氧化B. 溶液的pH不断减小
C. SO42-只向PbO2处移动D. 电解液密度不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g)△H1=+247kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+205kJ/mol
则CO2重整的热化学方程式为______。
(2)“亚硫酸盐法”吸收烟中的SO2,将烟气通入1.0mol/L的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断______(填“减小”、“不变”或“增大)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32-)=0.2mol/L,则溶液中c(HSO3-)=______;
(3)催化还原法去除NO.一定条件下,用NH3消除NO污染,其反应原理:4NH3+6NO![]() 5N2+6H2O.不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图1所示。
5N2+6H2O.不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图1所示。
①随温度升高NO脱除率下降的原因是______;
②曲线a中,NO的起始浓度为6×10-4mgm-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mgm-3s-1;
③曲线b对应NH3与NO的物质的量之比是______。
(4)间接电化学法除NO.其原理如图2所示:写出阴极的电极反应式(阴极室溶液呈酸性)______;
吸收池中除去NO的离子方程式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列说法正确的是

A. 化合物(A)不能与乙醇发生反应
B. 化合物(B)分子式为C6H6Cl6
C. 化合物(B)可通过苯与Cl2发生加成反应制得
D. 1mol化合物(A)可与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
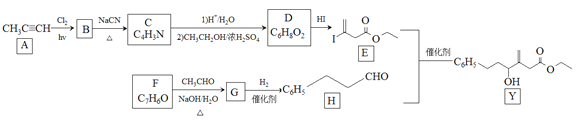
已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com