
【题目】在定温定容的密闭容器中合成 ![]() 。下列不能说明反应
。下列不能说明反应 ![]() 达到化学平衡状态的是
达到化学平衡状态的是
A.![]() B.容器内的压强不再改变
B.容器内的压强不再改变
C.![]() 的生成速率与
的生成速率与 ![]() 的消耗速率相等D.
的消耗速率相等D.![]() 的转化率不再改变
的转化率不再改变
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是 ______。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为______________ 。
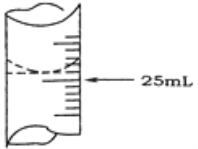
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为_____________ (小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高(_________) (填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现资源利用最大化,某化工厂将合成氨、制纯碱和生产尿素![]() 工艺联合,简易流程如下:
工艺联合,简易流程如下:

![]() 时101kPa时,测得生成17g
时101kPa时,测得生成17g![]() ,放出
,放出![]() 热量,写出合成
热量,写出合成![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
![]() 合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
![]() 反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______
反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______ ![]() 向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得
向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得![]() 反应器3中的化学方程式为 ______ .
反应器3中的化学方程式为 ______ .
![]() 工业上可用碳、甲烷与水蒸汽反应制氢气
工业上可用碳、甲烷与水蒸汽反应制氢气
![]() ,
,![]() ,此反应的化学平衡常数表达式为
,此反应的化学平衡常数表达式为![]() ______ ,为了提高碳的转化率,宜采用下列措施中的
______ ,为了提高碳的转化率,宜采用下列措施中的![]() 填字母编号
填字母编号![]() ______ .
______ .
A.增大压强![]() 增加碳的量
增加碳的量![]() 升高温度
升高温度![]() 增加水的量
增加水的量![]() 使用催化剂
使用催化剂![]() 及时移出CO、
及时移出CO、![]()
![]() 有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______
有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______
![]() 若仅以
若仅以![]() 、空气、
、空气、![]() 为原料制尿素
为原料制尿素 ,标准状况下
,标准状况下![]()
![]() ,理论上最多能制 ______
,理论上最多能制 ______ ![]() 尿素.
尿素.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 Z 的结构简式为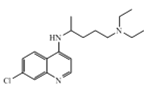 ,常进一步修饰后制成注射液使用,也可制成口服剂。如图为化合物 Z 的一种合成路线,先分别合成化合物F和Y,最后再用F 和 Y 反应获得化合物Z。
,常进一步修饰后制成注射液使用,也可制成口服剂。如图为化合物 Z 的一种合成路线,先分别合成化合物F和Y,最后再用F 和 Y 反应获得化合物Z。
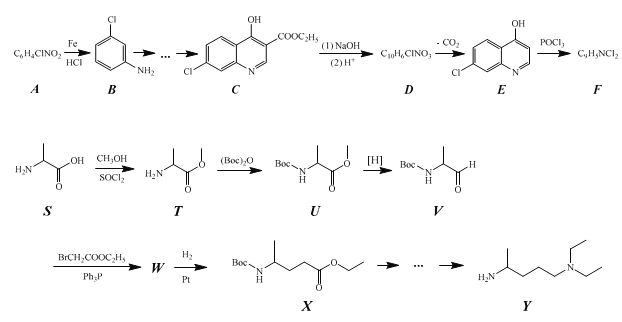
已知:
①![]()
![]()
![]()
②(Boc)2O=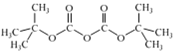 (其中Boc=
(其中Boc=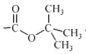 ,作答时建议用缩写符号来表示)
,作答时建议用缩写符号来表示)
③Ph3P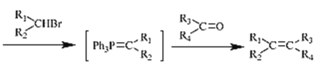 (其中-Ph为苯基,不考虑顺反异构)
(其中-Ph为苯基,不考虑顺反异构)
(1)化合物A 中含氧官能团的名称为__。
(2)生成化合物B的反应类型为__,由化合物F 和 Y 合成化合物Z 的反应类型为__。
(3)化合物C与足量NaOH水溶液反应,即化合物C到化合物D的转化步骤(1)的化学方程式为__。
(4)由化合物T到化合物U的反应还生成了CO2和一种醇,请写出这个醇的结构简式__。将化合物T与(Boc)2O反应制成化合物U再进行后续反应的目的是__。
(5)化合物W 的结构简式为__。
(6)作为药物时,化合物 Z 往往要进一步与磷酸反应制成磷酸盐使用。这么做的原因是:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,水质优劣直接影响人体健康,水处理技术在生产、生活中应用广泛。聚合硫酸铁(PFS)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)和废铁屑为原料制取聚合硫酸铁([Fe2(OH)x(SO4)3-![]() ]m)的工艺流程如图:
]m)的工艺流程如图:
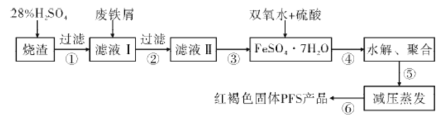
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______(填标号)。
a.容量瓶 b.烧杯 c.玻璃棒 d.分液漏斗
(2)废铁屑表面附有铁锈,铁锈的主要成分为______,步骤③的具体实验操作有____。
(3)水解、聚合要严控pH和温度。pH偏小时Fe3+水解程度弱,pH偏大时则______。写出水解、聚合反应生成PFS的化学方程式:_________。
(4)步骤⑥相对于常压蒸发,减压蒸发的优点是_________。
(5)污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质能作为沉淀剂的是_______(填标号)。
a.氨水 b.硫化氢气体 c.硫酸钠溶液 d.纯碱溶液
(6)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.5×10-3mol/L,c(Mg2+)=6.4×10-4mol/L,则此水的硬度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3mol/LB.Y2为0.45mol/L
C.X2为0.2mol/LD.Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,降低温度产生的影响为( )
2SO3(g) ΔH<0,降低温度产生的影响为( )
A.v正 增大,v逆减小B.v正减小,v逆增大
C.v正和v逆同程度的增大D.v正和v逆不同等程度的减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com