
【题目】化合物 Z 的结构简式为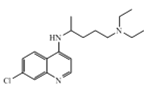 ,常进一步修饰后制成注射液使用,也可制成口服剂。如图为化合物 Z 的一种合成路线,先分别合成化合物F和Y,最后再用F 和 Y 反应获得化合物Z。
,常进一步修饰后制成注射液使用,也可制成口服剂。如图为化合物 Z 的一种合成路线,先分别合成化合物F和Y,最后再用F 和 Y 反应获得化合物Z。
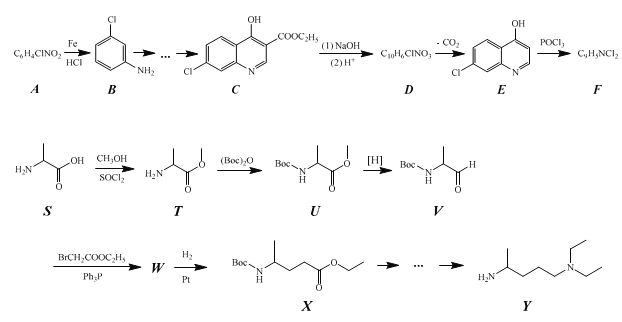
已知:
①![]()
![]()
![]()
②(Boc)2O=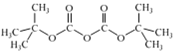 (其中Boc=
(其中Boc=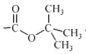 ,作答时建议用缩写符号来表示)
,作答时建议用缩写符号来表示)
③Ph3P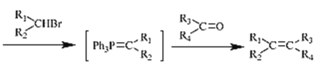 (其中-Ph为苯基,不考虑顺反异构)
(其中-Ph为苯基,不考虑顺反异构)
(1)化合物A 中含氧官能团的名称为__。
(2)生成化合物B的反应类型为__,由化合物F 和 Y 合成化合物Z 的反应类型为__。
(3)化合物C与足量NaOH水溶液反应,即化合物C到化合物D的转化步骤(1)的化学方程式为__。
(4)由化合物T到化合物U的反应还生成了CO2和一种醇,请写出这个醇的结构简式__。将化合物T与(Boc)2O反应制成化合物U再进行后续反应的目的是__。
(5)化合物W 的结构简式为__。
(6)作为药物时,化合物 Z 往往要进一步与磷酸反应制成磷酸盐使用。这么做的原因是:__。
【答案】硝基 还原反应 取代反应 ![]() +2NaOH→C2H5OH + H2O +
+2NaOH→C2H5OH + H2O + ![]() (CH3)3COH 保护氨基,防止副反应发生
(CH3)3COH 保护氨基,防止副反应发生 ![]() 增大药物的溶解性和稳定性
增大药物的溶解性和稳定性
【解析】
分析流程图中,结合B的结构简式和A的化学式,可以推导出A的结构简式![]() ,结合C的结构简式和C到D的反应条件,以及E的结构简式,可以推导出D的结构简式为:
,结合C的结构简式和C到D的反应条件,以及E的结构简式,可以推导出D的结构简式为:![]() ,结合E的结构简式和药物化合物Z可以推导出F的结构简式为:
,结合E的结构简式和药物化合物Z可以推导出F的结构简式为:![]() ,另一条线结合V和W的结构简式和中间反应的反应条件,可以推导出W的结构简式为:
,另一条线结合V和W的结构简式和中间反应的反应条件,可以推导出W的结构简式为: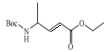 ,然后进行解答试题就不困难了。
,然后进行解答试题就不困难了。
(1)根据分析可知化合物A为![]() ,故其中含氧官能团的名称为硝基,故答案为:硝基;
,故其中含氧官能团的名称为硝基,故答案为:硝基;
(2)由化合物A![]() 生成化合物B
生成化合物B![]() 是硝基被还原为氨基,故反应类型为还原反应;由化合物F
是硝基被还原为氨基,故反应类型为还原反应;由化合物F![]() 和 Y
和 Y ![]() 合成化合物Z
合成化合物Z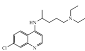 ,比较它们的结构简式可以得出,其反应类型为取代反应,故答案为:还原反应 取代反应;
,比较它们的结构简式可以得出,其反应类型为取代反应,故答案为:还原反应 取代反应;
(3)化合物C![]() 与足量NaOH水溶液反应,即化合物C到化合物D的转化步骤(1)的反应是酯基上水解和酚羟基上中和反应,故其化学方程式为
与足量NaOH水溶液反应,即化合物C到化合物D的转化步骤(1)的反应是酯基上水解和酚羟基上中和反应,故其化学方程式为![]() +2NaOH→C2H5OH + H2O +
+2NaOH→C2H5OH + H2O + ![]() ,故答案为:
,故答案为:![]() +2NaOH→C2H5OH + H2O +
+2NaOH→C2H5OH + H2O + ![]() ;
;
(4)由化合物T![]() 和(Boc)2O反应制备化合物U
和(Boc)2O反应制备化合物U![]() 的反应还生成了CO2和一种醇,又知(Boc)2O=
的反应还生成了CO2和一种醇,又知(Boc)2O=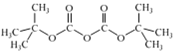 (其中Boc=
(其中Boc=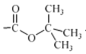 ),不难分析得出这个醇的结构简式(CH3)3COH,流程张将化合物T与(Boc)2O反应制成化合物U是将氨基保护起来,最终中间体Y中又出现氨基,故这样做的目的是保护氨基,防止副反应发生,故答案为:保护氨基,防止副反应发生;
),不难分析得出这个醇的结构简式(CH3)3COH,流程张将化合物T与(Boc)2O反应制成化合物U是将氨基保护起来,最终中间体Y中又出现氨基,故这样做的目的是保护氨基,防止副反应发生,故答案为:保护氨基,防止副反应发生;
(5) 结合V和W的结构简式和中间反应的反应条件,可以推导出W的结构简式为: ,故答案为:
,故答案为: ;
;
(6)作为药物时,化合物 Z 往往要进一步与磷酸反应制成磷酸盐使用。这么做的原因是:转化为铵盐增大其溶解性,由于氨基具有较强的还原性,转化为盐后性质更加稳定,故答案为:增大药物的溶解性和稳定性。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述正确的是
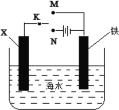
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为碳棒,开关K置于N处,会加快铁的腐蚀
C.若X为锌,开关K置于M处,是牺牲阳极的阴极保护法
D.若X为锌,开关K置于N处,铁电极发生的反应为:Fe-2e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍(NiSO4)是一种重要的化工原料,广泛应用于电镀、医药、印染等工业。以含镍废催化剂(主要含Ni及少量的Al、Al2O3、Fe和其它不溶于酸、碱的杂质)为原料生产NiSO4·7H2O晶体的两种工艺流程如下:
流程一:
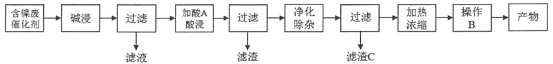
流程二:

已知:部分金属氢氧化物的Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
回答下列问题:
(1)流程一中所用酸A和流程二中所用酸X___________(填“相同”或“不相同”);流程一中滤渣C和流程二中滤渣II___________(填“相同”或“不相同”)。流程二中滤渣I是___________。
(2)流程一中“碱浸”时发生反应的离子方程式为_________________、___________________。
(3)流程二中“净化除杂”包含了两步操作过程:第一步,加入氧化剂H2O2,发生反应的离子方程式是____________________________________________;第二步,调节溶液的pH。
(4)分析比较流程一中操作B和流程二中操作Y后,回答操作Y是___________、___________、过滤、洗涤、干燥,即得产物。
(5)由己知信息列式计算:常温下,Ni2+完全沉淀时的pH值___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、杀菌、脱色、除臭的新型高效水处理剂,工业上可通过 Fe(NO3)3 与NaClO在强碱性介质中反应生成紫红色高铁酸盐溶液,其对应的工业流程如图所示。有关说法正确的是( )
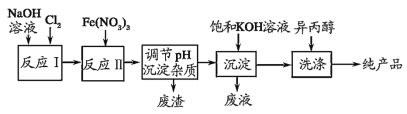
A.K2FeO4能够作为净水剂的原因,在于其氧化产物能够水解生成氢氧化铁胶体
B.反应II的离子方程式为 3ClO+5H2O+2Fe3+=2![]() +3Cl+10H+
+3Cl+10H+
C.向Na2FeO4 中加入饱和KOH 溶液,析出K2FeO4 沉淀,说明K2FeO4 的溶解度比Na2FeO4 大
D.洗涤粗品时选用异丙醇而不用水,可以减少K2FeO4的溶解损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,原理如图所示,淡水最终在X和Z室中流出。下列说法不正确的是
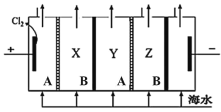
A.一般海水中含有的 Ca2+、Mg2+容易生成沉淀堵塞离子交换膜,因此不能直接通入阴极室
B.阳极发生电极反应:2Cl2e=Cl2↑
C.电渗析过程中阴极附近pH值升高
D.A膜为阳离子交换膜,B膜为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是
2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是

A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d (t1时刻)和点e (t2时刻)处n(SO2)不一样
D.其他条件不变,600℃时反应至t1时刻,n(SO 3)比上图中的e点值要大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温定容的密闭容器中合成 ![]() 。下列不能说明反应
。下列不能说明反应 ![]() 达到化学平衡状态的是
达到化学平衡状态的是
A.![]() B.容器内的压强不再改变
B.容器内的压强不再改变
C.![]() 的生成速率与
的生成速率与 ![]() 的消耗速率相等D.
的消耗速率相等D.![]() 的转化率不再改变
的转化率不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下,有两种较稀的醋酸溶液A和B。A溶液中c(CH3COOH)=a mol·L-1,电离度为α1,B溶液中c(CH3COO-)=a mol·L-1,电离度为α2。下列叙述中正确的是( )
A.B溶液中c(CH3COOH)= ![]() mol·L-1
mol·L-1
B.A溶液的pH值小于B溶液的pH值
C.α2>α1
D.A溶液的c(H+)是B溶液c(H+)的0.5α1倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com