
【题目】下面是几种有机物之间的转化关系:

(1)反应①,用 O2 氧化,反应条件为_________________。
(2)反应③的化学方程式是___________________。
(3)用 18O 标记乙醇分子中的氧原子,反应⑤生成物中含 18O 的物质结构简式是______________。
【答案】Cu作催化剂并加热 CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O CH3CH2CH2OOC2H5
CH2=CH2+NaBr+H2O CH3CH2CH2OOC2H5
【解析】
由转化关系可知,反应①为丙醇转化为丙醛,为醇的催化氧化,反应②为丙醛转化为丙酸,发生醛的氧化反应,反应③为卤代烃的消去生成乙烯,反应④为烯烃的加成反应生成醇,反应⑤为酯化反应,酸脱羟基醇脱氢,据此解答。
(1).反应①为醇的催化氧化,反应条件为Cu、加热,故答案为:Cu作催化剂并加热;
(2).反应③为溴乙烷发生消去反应生成乙烯,反应方程式为:CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O,故答案为:CH3CH2Br+NaOH
CH2=CH2+NaBr+H2O,故答案为:CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O;
CH2=CH2+NaBr+H2O;
(3).发生酯化反应时,酸脱羟基醇脱氢,则用18O标记乙醇分子中的氧原子应在丙酸乙酯中,故答案为:CH3CH2CH2OOC2H5。


科目:高中化学 来源: 题型:
【题目】 一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为
A.1.12L B.2.24L C.3.36L D.4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池广泛用作各种电子仪器的电源,其电极分别为![]() 和
和![]() ,电解质溶液为
,电解质溶液为![]() 溶液,总反应式为
溶液,总反应式为![]() 。下列说法不正确的是( )。
。下列说法不正确的是( )。
A.原电池放电时,负极上发生反应的物质是![]()
B.负极的电极反应是![]()
C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强
D.溶液中的![]() 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA (气) ![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质A的质量分数增加了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用溢流法连续制备无水四氯化锡,实验装置图如图:

查阅资料可知:
①Sn(s)+2Cl2(g)=SnCl4(l) ΔH=-511kJ/mol
②SnCl4易挥发,极易发生水解。
③相关物质的物理性质如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
密度/g·cm-3 | 7.310 | 2.226 | 3.386 |
回答下列问题:
(1)a管的作用是__________。
(2)A中反应的离子方程式是__________。
(3)D中冷却水的作用是________________。
(4)尾气处理时,可选用的装置是__________(填序号)。

(5)锡粒中含铜杂质致D中产生CuCl2,但不影响E中产品的纯度,原因是________。
(6)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3=SnCl4+2FeCl2,再用0.1000mol/LK2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液20.00mL,则SnCl4产品的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Na2SO3固体在隔绝空气加热条件下的分解产物,设计如下实验流程:
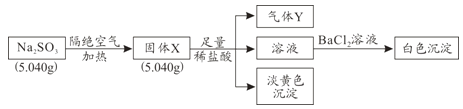
已知:气体Y是一种纯净物,在标准状况下密度为1.518g/L。
请回答下列问题:
(1)气体Y为_______。
(2)固体X与稀盐酸反应产生淡黄色沉淀的离子方程式为_______。
(3)实验过程中若测得白色沉淀的质量为6.291g,则Na2SO3的分解率为_______。
(4)Na2SO3在空气易被氧化,检验Na2SO3是否氧化变质的实验操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 ( )
A. 100 mL的盐酸中HCl的物质的量浓度为7.5 mol·L-1
B. 生成的H2S气体在标准状况下的体积为2.24 L
C. 该磁黄铁矿FexS中,x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
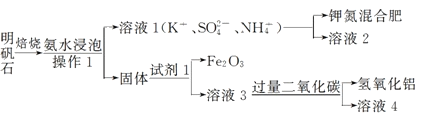
请回答下列问题:
(1)操作l所用到的玻璃仪器的名称是______________________。
(2)由溶液3制取氢氧化铝的离子方程式为__________。
(3)明矾石焙烧时产生SO2气体,请你写出能验证SO2气体具有还原性且实验现象明显的化学方程式________________________。
(4)请你写出验证溶液l中有NH4+的实验过程___________。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
①请你按气流由左到右方向连接下列各装置,顺序为:A→_________________。
②检验装置A气密性的方法是______________________。
③在点燃B处的酒精灯前,应进行的操作是____________________。
④装置C的作用是_________________________。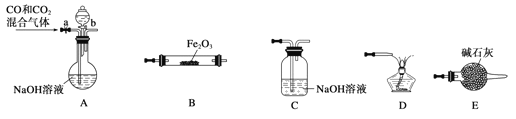
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com