
【题目】氨水中不存在的粒子是
A. NH3 B. N3- C. NH4+ D. OH-
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】2018年10月21日,港珠澳大桥正式开通,该桥的建成创下多项世界之最,其中仅大桥主梁使用的钢材42万吨。下列材料中不属于铁合金的是
A. 生铁 B. 铁锈 C. 不锈钢 D. 铁锰合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为mol/L.从中取出10mL,其物质的量浓度为mol/L,稀释成100mL后,溶液的浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;③和⑦形成的一种常见溶剂的化学式为________,其密度比水________。
(3)元素⑥原子的外围电子排布图为________;该元素与同主族相邻元素的氢化物的稳定性从大到小为________________ 。
(4)元素①的第一电离能________元素③(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z , 研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( ) 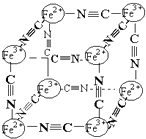
A.该晶体是原子晶体
B.M的离子位于上述立方体的面心,呈+2价
C.M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50%
D.晶体的化学式可表示为MFe2(CN)3 , 且M为+1价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为0.1L的密闭容器中,通入0.4molN2和1.2molH2,进行反应,2s后达到平衡,此时容器内的压强为起始时的3/4,试回答:
(1)能判断该反应达到平衡状态的依据是___________
A.断开3molH—H键的同时断开2molN—H键 B.c(N2) : c(H2): c(NH3) =1:3:2
C.混合气体的平均相对分子质量不变 D.容器内密度不变
(2)N2的转化率α1%=_________,若相同条件下,此反应在容积可变的容器中进行,保持压强不变,达到平衡,则N2的转化率α2%________α1%(填“>”、“<”或“=”)
(3)该温度下,反应的化学平衡常数K=__________,若此时再加入0.6molN2和0.4mol NH3,则平衡_______________(填“向左移动”、“向右移动”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸能腐蚀玻璃。25℃下,向20mL0.2molL-1的氢氟酸中滴加0.2molL-1的NaOH溶液时,溶液的pH变化如图所示。

已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____,电离度α(HF)为______%。
(3)下列有关图中各点微粒浓度关系正确的是________。
a.在A处溶液中:c(F—)+c(HF)=0.2 molL-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序 ___________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com