
【题目】氢氟酸能腐蚀玻璃。25℃下,向20mL0.2molL-1的氢氟酸中滴加0.2molL-1的NaOH溶液时,溶液的pH变化如图所示。

已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____,电离度α(HF)为______%。
(3)下列有关图中各点微粒浓度关系正确的是________。
a.在A处溶液中:c(F—)+c(HF)=0.2 molL-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序 ___________________________________________
【答案】 ad a 5.3×10-4 或5×10-4 5 b d C(F-)>C(Na+)> C(HF) >C(H+)>C(OH_)
【解析】(1)HF酸中存在HF H+ + F-,电离度![]() ,平衡常数Ka只与温度有关。a、HF的电离吸热,升高温度,平衡右移,电离度增大,Ka增大;b、向溶液中滴入2滴浓盐酸, H+浓度增大,平衡左移,电离度减小,Ka不变;c、加入少量NaF固体,F-浓度增大,平衡左移,电离度减小,Ka不变;d、加水稀释,促进电离,电离度增大,Ka不变。
,平衡常数Ka只与温度有关。a、HF的电离吸热,升高温度,平衡右移,电离度增大,Ka增大;b、向溶液中滴入2滴浓盐酸, H+浓度增大,平衡左移,电离度减小,Ka不变;c、加入少量NaF固体,F-浓度增大,平衡左移,电离度减小,Ka不变;d、加水稀释,促进电离,电离度增大,Ka不变。
故答案为:ad;a;
(2)由图象可知0.2molL-1的氢氟酸pH=2, c(H+)=0.01mol/L,则已电离c(HF)=0.01mol/L,α=![]() ,Ka=
,Ka=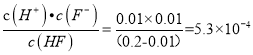
故答案为:5.3×10-4 或5×10-4; 5;
(3)a、该选项考查物料守恒,20mL0.2molL-1的氢氟酸中,物料守恒为:c(F-)+c(HF)=0.2molL-1,在A处溶液中,由于加入NaOH溶液,则溶液总体积大于20mL,则c(F-)+c(HF)<0.2molL-1,故a错误;b、在B处溶液中,HF和NaOH完全反应生成NaF,由质子守恒可知:c(H+)+c(HF)=c(OH-),故b正确;c、在B处溶液pH>7,则c(H+)<c(OH-),故c错误;d、由于温度不变,则电离常数不变,则在A和B处溶液中都符合: 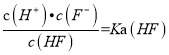 ,故d正确。
,故d正确。
故答案为:bd;
(4)向此氢氟酸溶液中滴加10mL NaOH溶液,反应后溶液为等物质的量HF和NaF的混合物,HF过量,溶液呈酸性,离子浓度大小关系应为c(F-)>c(Na+)>c(HF)>c(H+)>c(OH-),
故答案为:c(F-)>c(Na+)>c(HF)>c(H+)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】下列事实能说明甲酸![]() 属于弱酸的是( )
属于弱酸的是( )
①1mol/LHCOOH的pH=2 ②甲酸能与水以任意比互溶
③20mL 1mol/LHCOOH与20mL 1mol/LNaOH恰好中和 ④HCOONa溶液的pH>7
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律和元素周期表的论述中正确的是( )。
A. 对元素周期表有突出贡献的科学家是门捷列夫
B. 元素周期律是元素周期表的具体表现形式
C. 同一周期从左到右,元素原子半径逐渐增大
D. 同一主族的元素从上到下金属性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金在生产和生活中具有广泛的应用,下列用品中所用的材料不属于合金的是
A. 铁锅 (生铁) B. 刀具(不锈钢) C. 体温计(水银) D. 高压锅(硬铝)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl22H20),为制取纯净的CuCl22H20,首先将其制成水溶液,然后按如图步骤进行提纯: 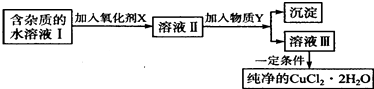
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
请回答下列问题.
(1)最适合作氧化剂X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物质Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ获得CuCl22H2O,需要经过、、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用(“酸式”或“碱式”)滴定管.反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LH2O含NA个分子
B.18gH2O中含有的质子数为10NA
C.2gH2所含原子数目为NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路(One Belt And One Road)”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易的商品中,其主要成分不属于有机物的是
A.中国丝绸B.埃及长绒棉C.乌克兰葵花籽油D.捷克水晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当温度不变时,恒容的容器中进行反应2AB,若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20秒,那么由0.06molL﹣1降到0.036molL﹣1 , 所需反应的时间为( )
A.等于10秒
B.等于12秒
C.大于12秒
D.小于12秒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com