
����Ŀ��һ�������£����ݻ�Ϊ0.1L���ܱ������У�ͨ��0.4molN2��1.2molH2�����з�Ӧ��2s��ﵽƽ�⣬��ʱ�����ڵ�ѹǿΪ��ʼʱ��3/4���Իش�
��1�����жϸ÷�Ӧ�ﵽƽ��״̬��������___________
A���Ͽ�3molH��H����ͬʱ�Ͽ�2molN��H�� B��c(N2) : c(H2): c(NH3) =1:3:2
C����������ƽ����Է����������� D���������ܶȲ���
��2��N2��ת������1%��_________������ͬ�����£��˷�Ӧ���ݻ��ɱ�������н��У�����ѹǿ���䣬�ﵽƽ�⣬��N2��ת������2%________��1%������>������<������=����
��3�����¶��£���Ӧ�Ļ�ѧƽ�ⳣ��K=__________������ʱ�ټ���0.6molN2��0.4mol NH3����ƽ��_______________�����������ƶ������������ƶ����������ƶ�����
���𰸡� C 50% > ![]() L2/mol2 ���ƶ�
L2/mol2 ���ƶ�
�������������������1��A���Ͽ�3molH-H����ͬʱ�Ͽ�2molN-H���������淴Ӧ���ʲ���ȣ�����˵����Ӧ����ƽ�⣬Ӧ���ǶϿ�3molH-H����ͬʱ�Ͽ�6molN-H��������B����Ӧ�ﵽƽ��״̬ʱ�������ʵ�Ũ�Ȳ��䣬��һ������c��N2����c��H2����c��NH3��=1��3��2������˵����Ӧ����ƽ�⣬����C���÷�Ӧ������仯�Ŀ��淴Ӧ����������ƽ����Է����������ŷ�Ӧ�Ľ���һֱ�ڸı䣬����ƽ��ʱ�����������������䣬���ʵ������䣬��Ħ���������䣬���Ի�������ƽ����Է����������䣬��˵����Ӧ����ƽ�⣬��ȷ��D�����κ�ʱ���������������䣬������������䣬���ܶȲ��䣬�����������ܶȲ��䣬����˵����Ӧ����ƽ�⣬����
��2����ת����N2�����ʵ���Ϊn��
N2��g��+3H2��g��2NH3��g����
��ʼ��mol�� 0.4 1.2 0
ת����mol�� n 3n 2n
ƽ�⣨mol�� 0.4-n 1.2-3n 2n
��ʱ�����ڵ�ѹǿΪ��ʼʱ��3/4���������ʵ���Ϊ��ʼ��3/4��0.4-n+1.2-3n+2n=1.6��3/4�����n=0.2��N2��ת������1%=0.2mol��0.4mol��100%=50%�����ڸ÷�Ӧ������������ٵķ�Ӧ���˷�Ӧ���ݻ��ɱ�������н��У��൱�����ں���������ѹǿ��ƽ�������ƶ���N2��ת��������
��3����Ӧ N2��g��+3H2��g��2NH3��g������ƽ��ʱ��������������������Ũ�ȷֱ�Ϊ��2mol/L��6mol/L��4mol/L����Ӧ�Ļ�ѧƽ�ⳣ��K=42��(2��63) L2/mol2=![]() L2/mol2������ʱ�ټ���0.6mol N2��0.4mol NH3��������������������Ũ�ȷֱ�Ϊ��8mol/L��6mol/L��8mol/L����Ӧ��Ũ����Qc=82��=(8��63) L2/mol2=
L2/mol2������ʱ�ټ���0.6mol N2��0.4mol NH3��������������������Ũ�ȷֱ�Ϊ��8mol/L��6mol/L��8mol/L����Ӧ��Ũ����Qc=82��=(8��63) L2/mol2=![]() L2/mol2=K������ƽ�ⲻ�ƶ���
L2/mol2=K������ƽ�ⲻ�ƶ���


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ����л��ij��ø����������Ĺ�ϵ��ͼ��ʾ�������й���������ȷ���ǣ� ��
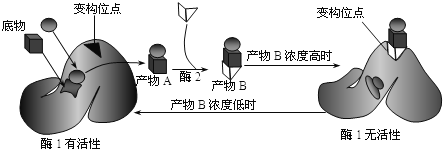
A��ø1�����B��Ϻ�ʧ�˵��ø�Ĺ�������ռ�ṹ����
B��ø1�ı乹λ��ͻ���λ��Ľṹȡ�����ض��İ���������
C��ø1�����ֵ������������B��ϣ����ø1������רһ��
D��ø1�����B������ÿ��Է�ֹϸ����������IJ���A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����β�ݷ����ڷ��ι������ɣ���β���������ת���õ���β�ݷӣ�����˵����ȷ���ǣ� �� 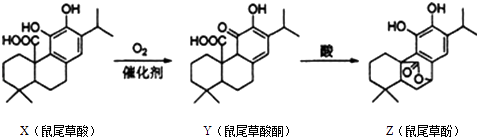
A.X��Y��Z���ڷ����廯����
B.X��Y��Z������FeCl3��Һ������ɫ��Ӧ
C.1 mol X��1mol Z��NaOH��Һ��Ӧ�����������3molNaOH
D.X��Y��Z������������Ȼ�̼��Һ�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0���l0lkPa�������£���1.40g������1.60g������ϣ��û��������ܶ�����ͬ�����������ܶȵ�
A. 15�� B. 14�� C. 14-16��֮�����ⱶ�� D. 16��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����β�ݷ����ڷ��ι������ɣ���β���������ת���õ���β�ݷӣ�����˵����ȷ���ǣ� �� 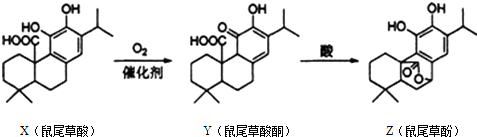
A.X��Y��Z���ڷ����廯����
B.X��Y��Z������FeCl3��Һ������ɫ��Ӧ
C.1 mol X��1mol Z��NaOH��Һ��Ӧ�����������3molNaOH
D.X��Y��Z������������Ȼ�̼��Һ�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǰ�й��������ʿ�ѧЭͬ�������ĵĽ�ӱ�������������������������ˮ��ѧ����ȡ���ش�ͻ�ƣ��ڹ������״�ʵ����ˮ���ӵ��Ƿ��Ӽ��ֱ����ʹ�ý���ˮ��������繹�ͳ�Ϊ���ܣ���ͼa��ʵ������ʾ��ͼ��ͼb�����㵽��ͼƬ��һ���֣�ͼc��ͼb����Ӧ�Ľṹʾ��ͼ�������й�˵������ȷ���ǣ� �� 
A.ͼa��ʾʵ�������У����Ȼ�����Ϊ��Ե��Ĥ�㣬����Ϊ�Ȼ��ƾ��岻����
B.ͼb�DZ�ʾһ��H2O�����ڲ���������������ۼ��ṹ����ʾ��ͼ
C.ˮ���Ӽ��γ����ʹˮ���۵�ͷе�����
D.H2O���ӵ��ȶ��Ժ�ǿ������Ϊ�������������ۼ�ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��˵������![]() �����������( )
�����������( )
��1mol/LHCOOH��pH=2 �ڼ�������ˮ������Ȼ���
��20mL 1mol/LHCOOH��20mL 1mol/LNaOHǡ���к� ��HCOONa��Һ��pH>7
A. �٢� B. �ڢ� C. �ۢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�����������˵����ȷ���ǣ� ��
A.��״���£�22.4LH2O��NA������
B.18gH2O�к��е�������Ϊ10NA
C.2gH2����ԭ����ĿΪNA
D.��1L2mol/L������þ��Һ�к��е������������Ϊ2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com