
【题目】鼠尾草酚用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( ) 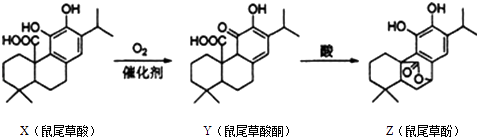
A.X、Y、Z属于芳香族化合物
B.X、Y、Z均能与FeCl3溶液发生显色反应
C.1 mol X或1mol Z与NaOH溶液反应,均最多消耗3molNaOH
D.X、Y、Z均能与溴的四氯化碳溶液发生加成反应
【答案】C
【解析】解:A.芳香族化合物中含有苯环,B中不含苯环,所以不属于芳香族化合物,故A错误; B.含有酚羟基的有机物能和氯化铁发生显色反应,B中不含酚羟基,不能和氯化铁发生显色反应,故B错误;
C.X中羧基和酚羟基能和NaOH反应,Z中酚羟基、酯基水解生成的羧基能和NaOH反应,所以1 mol X或1mol Z与NaOH溶液反应,均最多消耗3molNaOH,故C正确;
D.碳碳不饱和键能和溴发生加成反应,X和Z中不含碳碳不饱和键,所以不能和溴发生加成反应,故D错误;
故选C.
【考点精析】认真审题,首先需要了解有机物的结构和性质(有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解).


科目:高中化学 来源: 题型:
【题目】萌发的小麦种子中有α淀粉酶和β淀粉酶。α淀粉酶较耐热,但在pH为3.6下可迅速失活,而β淀粉酶不耐热,在70°C条件下15min后失活。
实验材料和用具:萌发的小麦种子、麦芽糖标准液、5%淀粉溶液、斐林试剂、蒸馏水、水浴锅等。
实验步骤:
一:制作麦芽糖梯度液。取7支干净的试管,编号,按表加入试剂后60℃水浴加热2min。
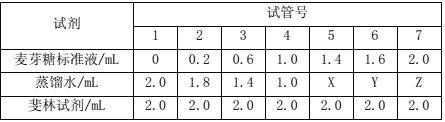
二:用萌发的小麦种子制备淀粉酶溶液。
三:将装有淀粉酶溶液的试管70℃水浴15min后迅速冷却。
四:另取4支试管,编号A、B、C、D,向A、B试管中各加5mL5%淀粉溶液,向C、D试管中各加2mL已经处理的酶溶液(忽略其中含有的少量麦芽糖)和蒸馏水,将4支试管40℃水浴10min。将C、D试管中的溶液分别加入到A、B试管中,摇匀后继续40℃水浴10min。
五:取A、B试管中反应溶液各2mL分别加入E、F试管,然后向E、F试管分别加入 ,并进行 ,观察颜色变化。
结果分析:将E试管中颜色与步骤一中获得的麦芽糖标准液进行比较,获得该试管中麦芽糖浓度,并计算出α淀粉酶催化效率。请分析回答:
(1)本实验的目的是测定小麦种子中 。
(2)步骤一的57试管中加入蒸馏水的量(X、Y、Z)分别是 、 、 (单位mL)。
(3)实验中B试管所起的具体作用是检测实验使用的淀粉溶液中 。
(4)若要测定另一种淀粉酶的活性,则需在第 步骤进行改变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法,不正确的是

A. 甲图四种化合物中“0”内A所对应含义的解释有一个是错误的
B. 硝化细菌体内含有甲图中的四种化合物
C. 若乙图表示某种酶在不同温度下催化某反应的效果图,则温度a>b>c
D. 若乙图表示不同浓度的某种酶催化某反应的效果图,则酶浓度a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为mol/L.从中取出10mL,其物质的量浓度为mol/L,稀释成100mL后,溶液的浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z , 研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( ) 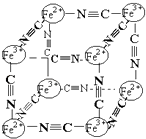
A.该晶体是原子晶体
B.M的离子位于上述立方体的面心,呈+2价
C.M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50%
D.晶体的化学式可表示为MFe2(CN)3 , 且M为+1价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;③和⑦形成的一种常见溶剂的化学式为________,其密度比水________。
(3)元素⑥原子的外围电子排布图为________;该元素与同主族相邻元素的氢化物的稳定性从大到小为________________ 。
(4)元素①的第一电离能________元素③(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为0.1L的密闭容器中,通入0.4molN2和1.2molH2,进行反应,2s后达到平衡,此时容器内的压强为起始时的3/4,试回答:
(1)能判断该反应达到平衡状态的依据是___________
A.断开3molH—H键的同时断开2molN—H键 B.c(N2) : c(H2): c(NH3) =1:3:2
C.混合气体的平均相对分子质量不变 D.容器内密度不变
(2)N2的转化率α1%=_________,若相同条件下,此反应在容积可变的容器中进行,保持压强不变,达到平衡,则N2的转化率α2%________α1%(填“>”、“<”或“=”)
(3)该温度下,反应的化学平衡常数K=__________,若此时再加入0.6molN2和0.4mol NH3,则平衡_______________(填“向左移动”、“向右移动”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于丙醇(CH3CH2CH2OH)分子的说法正确的是( )
A.分子中共含有11个极性键
B.分子中含有配位键
C.分子中只含σ键
D.分子中含有1个π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com