
����Ŀ����һ����ʶ������ԭ��Ӧ���Ȼ�刺ɳ�ȥͭ�����������ͭ��![]()
��1��������ԭ��Ӧ��ʵ����__________����д��ţ���
A��������ʧ�� B�����ϼ۵����� C���������������� D�����ӵĵ�ʧ��ƫ��
��2���õ����ű��������Ӧ�е���ת�Ƶķ������Ŀ________��
��3��������Ӧ�У��Ȼ����N�Ļ��ϼ�_______������������������������_____������������ʧ�������ӣ���____������������������ԭ������������_____����������������ԭ�����ԣ�����____����������������ԭ������Ӧ��
��4���������ͻ�ԭ�����ʵ���֮����___��
��5��������![]() 11.2 L����״����ʱ��ת��___�����ӣ�����ԭ��CuO__mol��
11.2 L����״����ʱ��ת��___�����ӣ�����ԭ��CuO__mol��
���𰸡�D  ���� ʧ ��ԭ�� ��ԭ ���� 3��2 3NA 1.5
���� ʧ ��ԭ�� ��ԭ ���� 3��2 3NA 1.5
��������
������ԭ��Ӧ�ı���Ϊ���ӵ�ת�ƣ���ʧ��ƫ�ƣ�����������Ԫ�ػ��ϼ۵ı仯��4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O��Ӧ�У�CuO�е�ͭԪ����+2�۽��͵�0�ۣ�������ԭ��Ӧ������������NH4Cl�е�Ԫ����-3�����ߵ�0�ۣ�����������Ӧ������ԭ��������ת�Ƽ���ظ����Ĺ�ϵΪ��6e----N2��3CuO(����ԭ)���ݴ˽��м��㡣
��1��������ԭ��Ӧ�ı���Ϊ���ӵ�ת�ƣ���ʧ��ƫ�ƣ�����������Ԫ�ػ��ϼ۵ı仯��
�ʴ�ѡD��
��2��4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O��Ӧ�У�CuO��Cu��ͭԪ����+2�۽��͵�0�ۣ��õ�2�����ӣ�3molCuO��3Cu�����õ�����6mol���ӣ�����Ӧת�Ƶĵ���Ϊ6mol�� �����ű��������Ӧ�е���ת�Ƶķ������Ŀ���£� ��
��
�ʴ��ǣ� ��
��
��3��4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O��Ӧ�У��Ȼ���е�Ԫ����-3�����ߵ�0�ۣ�ʧ���ӣ�����������Ӧ������ԭ�������ֻ�ԭ�ԣ�
�ʴ��ǣ����ߣ�ʧ����ԭ������ԭ��������
��4��4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O��Ӧ�У�NH4Cl����ԭ����ȫ�������������Ի�ԭ����2mol��4molCuO����3molCuO����ԭ�����������������������ͻ�ԭ�����ʵ���֮����3mol��2mol=3:2��
�ʴ��ǣ�3:2��
��5������ ��֪��6e----N2��3CuO(����ԭ)�����Ե���������Ϊ11.2L/22.4L/mol=0.5molʱ��ת��3mol���ӣ�����Ϊ3NA������ԭ��CuOΪ1.5mol��
��֪��6e----N2��3CuO(����ԭ)�����Ե���������Ϊ11.2L/22.4L/mol=0.5molʱ��ת��3mol���ӣ�����Ϊ3NA������ԭ��CuOΪ1.5mol��
�ʴ��ǣ�3NA��1.5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯���������з�����Ӧ��![]() Fe2O3(s)��CO(g)
Fe2O3(s)��CO(g) ![]()
![]() Fe(s)��CO2(g)���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ��������
Fe(s)��CO2(g)���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ��������
�¶�T/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ��K | 4.0 | 3.7 | 3.5 |
����˵����ȷ����
A. ���Ӹ�¯�ĸ߶ȿ�����Ч��������β����CO�ĺ���
B. �ɱ������ݿ��жϸ÷�Ӧ����Ӧ������������������������
C. Ϊ��ʹ�÷�Ӧ��K��������������������ʱ������c(CO)
D. 1000����Fe2O3��CO��Ӧ��t min�ﵽƽ��ʱc(CO) =2��10-3 mol/L������CO��ʾ�÷�Ӧ��ƽ������Ϊ![]() mol/(L��min)
mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣺
��1���ʻ���[Fe��CO��5]��ʹ�ϳɼ״��ͺϳɰ������������еĴ����ж���Fe��CO��5�����³�Һ̬���۵�Ϊ��20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿����ж�Fe��CO��5��������Ϊ__��
��2����ѧ��ͨ��X����̽����MgO��CaO�ľ���ṹ��NaCl����ṹ���ƣ���ͼ��ʾ��

�ٱȽϾ����۵�ĸߵ�MgO__CaO������ڡ����ڡ�����
��Mg2+����λԭ�������ɵ����弸�ι���Ϊ__����MgCO3�����ܴ���CaCO3��Ϊ��MgCO3���ֽ�__��
��3��Ni�Ķѻ���MgO����ԭ�Ӷѻ���ͬ��Ni��������H2�����Ե���ԭ����ʽ�����������϶����Ni���������H2��n��Ni����n��H��=__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч�����������ⷽ����������ͼ���£�

��ط�Ӧ���Ȼ�ѧ����ʽΪ��
��ӦI��SO2(g) + I2(g) + 2H2O(l) === 2HI(aq) + H2SO4(aq) ��H1 =��213 kJ��mol-1
��ӦII��H2SO4(aq) === SO2(g) + H2O(l) + ![]() O2(g) ��H2 = +327 kJ��mol-1
O2(g) ��H2 = +327 kJ��mol-1
��ӦIII��2HI(aq) === H2(g) + I2(g) ��H3 = +172 kJ��mol-1
����˵������ȷ���ǣ�
A. �ù���ʵ����̫���ܵ���ѧ�ܵ�ת��
B. SO2��I2���ܷ�Ӧ���˴���������
C. �ܷ�Ӧ���Ȼ�ѧ����ʽΪ��2H2O(l) === 2H2 (g)+O2(g) ��H = +286 kJ��mol-1
D. �ù��̽�����ˮ�ֽ����ⷴӦ�Ļ�ܣ����ܷ�Ӧ����H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ�ֻ���ɫ���壬������ˮ���ڻ�������е������������ 10���Ϳ��ܷ�����ը���ڹ�ҵ�ϳ�����ˮ��������Ư����ijС�鰴������ʵ��װ���Ʊ� ClO2 ����֤��ijЩ���ʡ���ش��������⣺

(1)ͨ�뵪������Ҫ������ 2 ����һ�ǿ����������ã�����____________________��(2)���ڸ�ʵ�飬����˵����ȷ����___________��
A.װ�� A ������ H2O2 ��ȡ ClO2 ���壬�䷴Ӧ�Ļ�ѧ����ʽΪ2NaClO3��3H2O2��H2SO4��2ClO2����Na2SO4��2O2����4H2O
B.װ�� B �����ռ�������������
C.������װ�� C �е���Һ������ʱӦ�Ӵ�����ͨ����
D.����������ɱ�����������������л����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˽Ⲣ�������ʵ��ڲ��ṹ�Լ���ѧ���;������Ϳ��������Ǹ��õ��˽��������硣��֪��ʵ������![]() ���Ȼ��⣬����ˮ�γ����ᡣ
���Ȼ��⣬����ˮ�γ����ᡣ
��1��д��ԭ�ӵĽṹʾ��ͼNa_______��Cl______��
��2��NaCl����ʽΪ___��������ѧ������_____������______���壻HCl����ʽΪ____��������ѧ������____������______���塣
��3���Ȼ�������ˮ�γ�����ĵ��뷽��ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KIO3 ��һ����Ҫ�������������Ϊʳ���еIJ������������KClO3 ���������Ʊ� KIO3 ������������ͼ��ʾ���ش��������⣺
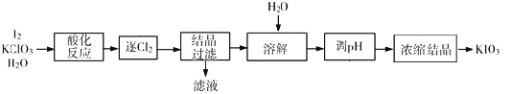
(1)���ữ��Ӧ�����ò����� KH(IO3)2��Cl2 �� KCl������ Cl2�����õķ�����________��
(2)����Һ���е�������Ҫ��_______������ pH���з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
(3)�ᾧ����ʱ���˷��� KH(IO3)2 Ϊ������״���������¿��Բ��õķ�����________��
A�������� B.�ؽᾧ�� C.���˷� D. ���ķ��뷨
(4)�����У����ʡȥ���ữ�����������������ᾧ�١�������������������ֱ�����Լ� X ������Ӧ����Һ�� pH���������������ʲô����Ӱ��_________________________________________________________________��
(5)KIO3 Ҳ�ɲ�������ⷨ���Ʊ���װ����ͼ��ʾ��������ⷨ����ȣ���KClO3 ������������Ҫ����֮����_____________________________________��(д��һ��)

(6)��֪��KIO3��5KI��3H2SO4=3K2SO4��3I2��3H2O��I2��2S2O32-=2I����S4O62-���ⶨ�ӵ�ʳ���е�ĺ�����ѧ������Ƶ�ʵ�鲽�����£�
a��ȷ��ȡ w g ʳ�Σ�����������ˮʹ����ȫ�ܽ⣻
b����ϡ�����ữ������Һ��������� KI ��Һ��ʹ KIO3 �� KI ��Ӧ��ȫ��
c���Ե���Ϊָʾ�����������ʵ���Ũ��Ϊ2.0��10-3mol��L-1 �� Na2S2O3 ��Һ 10.0mL ǡ�÷�Ӧ�� ��ӵ�ʳ����Ʒ�еĵ�Ԫ�غ�����______________mg/kg��(�Ժ� w �Ĵ���ʽ��ʾ)
(7)ѧ�����ֶԴ����� NaCl(���� KIO3)����������ʵ�飺
�������� | ʵ������ |
ȡ 1g ������ NaCl���� 3mL ˮ�����Һ�� | ��Һ�ޱ仯 |
���� 5 �ε�����Һ�� 1mL 0.1 mol��L��1KI ��Һ���� | ��Һ�ޱ仯 |
Ȼ���ٵ��� 1 �� 1mol��L��1 �� H2SO4���� | ��Һ����ɫ |
����ѧ���ҵ�ʵ���������ѧ����ʵ����������Ҫ����___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ����������ᣬ������ˮ��Ϊ�˲ⶨ���ᾧ��H2C2O4��xH2O�е�xֵ��ijʵ��С�����ʵ�飬�������£�
�ٳ�ȡ1.260g���ᾧ�壬���100mL��Һ��
��ȡ25.00mL��H2C2O4��Һ������ƿ�ڣ��ټ�������ϡ���ᡣ
����Ũ��Ϊ0.1000mol/L��KMnO4����Һ���еζ������ζ��ﵽ�յ㡣
���ظ�ʵ�顣��¼�����������£�
ʵ����� | V(KMnO4��Һ) | |
�ζ�ǰ�̶�/mL | �ζ���̶�/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
�ش��������⣺
(1)�Ҷ����KMnO4����Һ��Ӧ�����ӷ���ʽΪ____________
(2)�������Ҫʹ���ձ�����Ͳ������������ͷ�ιܣ���ȱ�ٵIJ�������Ϊ_______(������)������۵ζ������У�ʢװKMnO4��Һ������Ϊ__________________(������)��
(3)��ʵ��ζ��ﵽ�յ�ı�־��__________________________;
(4)�������ݣ�����H2C2O4��Һ�����ʵ���Ũ��Ϊ______mol/L��x=____________��
(5)���ζ��յ�ʱ���ӵζ��̶ܿȣ���xֵ��_____________(����ƫ��������ƫС������������) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е����Ų�ͼ��ÿһ��С�����ʾһ��ԭ�ӹ��������ʾԪ�ص�ԭ���У��������������״̬������ ��
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com