
【题目】在一个密闭容器(W)中,进行如下两个可逆反应:
①A(g)+2B(g) ![]() 3C(g)+D(s) △H1>0 ②xM(g)+N(g)
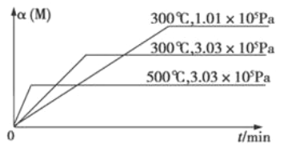
3C(g)+D(s) △H1>0 ②xM(g)+N(g) ![]() 3Q(g) △H2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。下列对W容器中进行的反应推断合理的是
3Q(g) △H2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。下列对W容器中进行的反应推断合理的是
A.反应①一定是自发反应,反应②一定是非自发反应
B.若容器内温度保持不变,则 v正(B): v逆(C)=2:3
C.若恒压条件下,充入N,则C的物质的量减小
D.升高温度,两个反应的平衡常数都减小
【答案】B
【解析】
试题分析:Ⅰ、在某容器中进行反应②时,测得M的转化率与温度,压强关系如图所示,依据”定一议二“和“先拐先平”温度、压强高,结合反应特征和M的转化率变化分析判断,反应速率之比等于化学方程式计量数之比为正反应速率之比;Ⅱ、因为W容器中反应①是吸热反应,绝热容器中,反应①正向进行,温度降低反应②正向进行,平衡常数增大,所以反应②是放热反应;若向容器W中再充入N,反应②正向进行,放热反应放出热量,促进反应①正向进行,A转化率增大,C的物质的量增大。A、①△G>0,△H>0,高温下能自发,而反应②、①△G>0,△H<0,一定能自发,故A错误;B、在某容器中进行反应Ⅱ时,测得M的转化率与温度,压强关系如图所示,依据”定一议二“和“先拐先平”温度、压强高,图象变化可知温度相同,压强越大,M转化率越小,说明平衡逆向进行,逆向是气体体积减小的反应,x+1<3,x<2,化学方程式计量数为整数1,容器W内温度保持不变时反应达到平衡状态,C的正反应速率等于逆反应速率,反应速率之比等于化学方程式计量数之比为正反应速率之比,得到v正(B):v逆(C)═2:3,故B正确;C、若向容器W中再充入N,反应②正向进行,放热反应放出热量,促进反应①正向进行,A转化率增大,C的物质的量增大,故C错误;D、反应①是吸热反应,升高温度,平衡常数增大;反应②是放热反应,升高温度,平衡常数减小,故D错误;故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】链型的不饱和油酸(C17H33COOH)与蔗糖反应可以制得非天然油脂,其反应示意图如图所示(图中的反应式不完整),则下列说法不正确的是( )

A.该非天然油脂与氢氧化钠溶液共热,产物可与溴的四氯化碳溶液反应
B.天然油脂、蔗糖、非天然油脂都能发生水解反应
C.蔗糖、葡萄糖分别与银氨溶液水浴加热反应,有相同的实验现象
D.植物油、非天然油脂都可以与H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物。某学习小组欲探究其分解产物。
I.甲组同学设计了如下实验装置。

(1)实验中,装置B中观察到的现象是____________________。
(2)碱石灰的主要作用是__________________。
(3)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有_____________(写化学式)。
(4)设计实验验证装置A中固体残留物不含FeO:___________________(简要说明实验操作、现象和结论)。
Ⅱ.乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和下列所示装置进行实验。

(5)乙组同学的实验装置中,依次连接的合理顺序为A、__________。装置G中盐酸的作用是_________________。
(6)实验中,准确称量摩尔盐7.8400 g,充分加热反应后,测得装置A中固体残留物的质量为1.6000 g,装置G中生成白色沉淀的质量为3.4950 g,装置H中收集到112 mL N2(标准状况下),写出摩尔盐受热分解的化学方程式:___________________。(分解产物被充分吸收,不考虑其损失)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1molN2O4置于1L密闭容器中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
A.N2O4的消耗速率与NO2的生成速率之比为1:2
B.烧瓶内气体的颜色不再加深
C.烧瓶内气体的平均相对分子质量不再变化
D.烧瓶内气体的压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒温恒压容器,乙为恒温恒容容器。初始时,两容器的温度、体积相同,两容器中均充入2molSO2和1molO2,且发生反应为2SO2(g)+O2(g) ![]() 2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中不可行的是
2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中不可行的是
A.向甲容器中再充入一定量的氦气 B.向乙容器中再充入2mol的SO3气体
C.适当降低乙容器的温度 D.增大甲容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. Fe(SCN)3溶液中存在Fe3++3SCN-![]() Fe(SCN)3,向此溶液中加入固体KSCN后颜色变深
Fe(SCN)3,向此溶液中加入固体KSCN后颜色变深
B. 用通过盛饱和食盐水的洗气瓶来除去氯气中的少量HCl气体杂质
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应)。达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应)。达平衡后,升高温度体系颜色变深
D. 合成氨:N2(g)+3H2(g)![]() 2NH3(g) △H<0在高温、高压和催化剂条件下进行
2NH3(g) △H<0在高温、高压和催化剂条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应3A(g)+B(g) ![]() xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请填写下列空白:
xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均反应速率为 。
(2)x= 。
(3)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol。
(4)保持温度和体积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是 (填字母)。
A.均减半 B.均加倍 C.均增加0.4mol D.均减小0.4mol
(5)如果上述反应在相同温度和容积的容器中进行,起始加入3molA和3molB,达到平衡时A的体积分数为a%。其它条件不变时,按下列配比作为起始物质,平衡时A的体积分数大于a%的是 (填字母)。
A.2molC B.1molA、3molB和4molC
C.1molB和4molC D.6molA和2molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是

A.该装置可以将光能转化为电能,同时也能转化为化学能
B.TiO2电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com