
【题目】在2L密闭容器中通入amolX气体并发生反应:2X(g)![]() Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
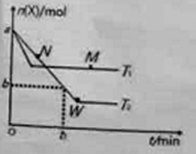
A.正反应方向为放热反应
B.在T2温度下,在0~t1时间内,v(Y)=![]()
C.M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D.W点时再加入一定量X,平衡后X的转化率增大
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】2SO2+O2![]() 2SO3是工业制硫酸的一步重要反应,下列说法正确的是
2SO3是工业制硫酸的一步重要反应,下列说法正确的是
A. 使用催化剂能改变该反应限度
B. 减小SO2的浓度能加快该反应的速率
C. 升高体系温度能加快反应速率
D. 1 mol SO2和足量的O2在一定条件下充分反应,生成1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是( )
A.NH4Cl的水解常数表达式:![]()
B.NaHCO3水解的离子方程式:HCO3- + H2O ![]() H3O + + CO32-
H3O + + CO32-
C.结构示意图为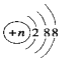 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D.H2SO3的电离方程式:H2SO3![]() 2H+ + SO32-
2H+ + SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液在生产生活中应用十分广泛。回答下列问题:
(1)氯化铁可用作净水剂,其原因是(用离子方程式表示)___。
(2)水玻璃在工业上可作粘合剂,它与NH4Cl溶液接触时,会很快凝结并放出刺激性气味的气体,其原因是(用离子方程式表示)___。
(3)浓度均为0.1mol·L-1的下列各溶液:①HCl ②NaOH ③Na2CO3 ④CH3COONa ⑤NH4Cl ⑥H2SO4 ⑦KCl ⑧CH3COOH,pH由小到大的排列顺序为___。
(4)已知在0.1mol·L-1NaHSO3 溶液中滴入石蕊试液变红,则0.1mol·L-1NaHSO3溶液中离子浓度大小关系为:___。
(5)将mmol/L的醋酸和nmol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__mol/L,m与n的大小关系是m__n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在科研、生产中有广泛应用。

(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g)![]() 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)=_________________________;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为_____________、__________________。
(2)常温下NH4+(aq)+H2O(l)![]() NH3H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3H2O的电离平衡常数K=______________________(保留三位有效数字)。
NH3H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3H2O的电离平衡常数K=______________________(保留三位有效数字)。
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线______________(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+______(g) ΔH2=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A.原子半径和离子半径均满足:Y>Z
B.氢化物的沸点不一定是:Y<R
C.最高价氧化物对应水化物的酸性:T>R
D.由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol·L-1·s-1。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___100℃(填“大于”或“小于”)。
(3)计算温度T时反应的平衡常数K2___(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用某浓度的NaOH溶液滴定20.00mL等浓度的CH3COOH溶液,所得滴定曲线如下图。下列说法正确的是
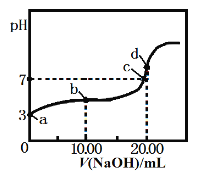
A. a点醋酸的浓度为1.0×10-3mol·L-1
B. a、b两点对应的醋酸电离平衡常数:a<b
C. c点c(Na+):c(CH3COO-)=1:1
D. d点溶液升高温度,溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果定义有机物的同系列是一系列结构式符合![]() (其中n=0、1、2、3……)的化合物。式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不可称为同系列的是
(其中n=0、1、2、3……)的化合物。式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不可称为同系列的是
A.CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3
B.CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3(CH=CH)3CHO
C.CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3
D.ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com