
【题目】下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:

(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的元素是________。(填元素符号)
(2)最高价氧化物的水化物中酸性最强的是________,呈两性的是________。
(3)在B、C、E、F中,原子半径最大的是________。
(4)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________。
(5)与C元素同族的第5周期元素X的价电子排布式________________。
【答案】 Ar F HClO4 Al(OH)3 Na Al(OH)3+NaOH===NaAlO2+2H2O 5s25p1
【解析】根据元素在周期表中的相对位置,首先判断出元素,然后结合元素周期律和相关物质的性质解答。
根据A~J在周期表中的位置可知A是H,B是Na,C是Al,D是C,E是N,F是P,G是F,H是Cl,I是Ar,J是Si。则
(1)表中元素,化学性质最不活泼的是稀有气体元素Ar。F是最活泼的非金属,只有负价而无正价的元素是F。
(2)非金属性越强,最高价含氧酸的酸性越强,F没有含氧酸,则最高价氧化物的水化物中酸性最强的是HClO4,呈两性的是Al(OH)3。
(3)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,因此在B、C、E、F中,原子半径最大的是Na。
(4)氢氧化铝是两性氢氧化物,与氢氧化钠溶液反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。
(5)与Al元素同族的第5周期元素X是In,其价电子排布式为5s25p1。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】始组鸟(pterodactyl adiene)形状如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是
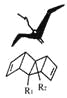
A. 始祖鸟烯与乙烯互为同系物
B. 若R1=R2=甲基,则其化学式C12H16
C. 若R1=R2=甲基,则始祖鸟烯的一氯代物有3种
D. 始祖鸟烯既能使酸性高锰酸钾褪色,也能使溴水褪色,则两反应的反应类型是相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】功能高分子I的一种合成路线如下,其中D能与Na反应生成H2,且D苯环上的一氯代物有2种。

已知:![]()
回答下列问题:
(1)A的名称为________,试剂a为________。
(2)C的结构简式为________。
(3)F中的官能团名称为________。
(4)上述①~⑧的反应中,不属于取代反应的是________(填数字编号)。写出反应⑦的化学方程式________。
(5)符合下列条件的B的同分异构体有________种(不考虑立体异构)。
①苯环上有氨基(—NH2) ②能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的结构简式为________。
(6)参照上述合成路线,以1-丁烯为原料(无机试剂任选),设计制备乳酸(![]() )的合成路线________。
)的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热。下列是一些化学键的键能。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol | 414 | 489 | 565 | 155 |
根据键能数据估算反应CH4+4F2=CF4+4HF每消耗1mol CH4的热效应( )
A. 放热1940 kJ B. 吸热1940 kJ C. 放热485 kJ D. 吸热485 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A+、B-、C2-、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示)。
(2)B的单质可用来制“84”消毒液的主要成分,写出反应的离子方程式_____________。
(3)用文字描述比较B、C两元素的非金属性强弱的方法(必要时可用方程式,至少一条):________________。
(4)D是由两种元素组成的双原子分子,用电子式表示其形成过程___________________。
(5)E是所有含18个电子的微粒中氧化能力最强的分子,其与水反应的化学方程式为________。
(6)F分子中含有4个原子,既有极性键又有非极性键,其电子式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。

(1)加热前通入氮气的目的是_____________,操作方法为______________。
(2)装置A、C、D中盛放的试剂分别为A________,C________,D________。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将_______(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将________;若撤去E装置,则测得Na2CO3·10H2O的含量将________。
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为_______(用含w、m1、m2的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个分解反应:N2O5N2O3+O2 , N2O3N2O+O2 , 在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是( )
A.c(N2O5)=1.44 mol/L
B.c(N2O5)=0.94 mol/L
C.c(N2O)=1.40 mol/L
D.c(N2O)=3.48 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列关于聚乙炔叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]() ,分子中所有碳原子在同一直线上
,分子中所有碳原子在同一直线上
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂自身不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍具有较高的经济价值。工业上采用一定方法处理含镍废水使其达标排放并回收镍。某电镀废水中的镍主要以NiRz络合物形式存在,在水溶液中存在以下平衡: NiR2(aq) ![]() Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
(1)传统的“硫化物沉淀法”是向废水中加入Na2S,使其中的NiR2 生成NiS 沉淀进而回收镍。
①该反应的离子方程式为_______________。
②NiS 沉淀生成的同时会有少量Ni(OH)2沉淀生成,用离子方程式解释Ni(OH)2生成的原因是______________。
(2)“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。工艺流程如下:

“脱络”(指镍元素由络合物NiR2转化成游离的Ni3+) 过程中,R-与中间产物-OH (羟基自由基) 反应生成难以与Ni2+络合的-R (有机物自由基),但-OH也能与H2O2发生反应。反应的方程式如下:Fe2+ + H2O2 = Fe3+ +OH-+-OH i
R- +-OH =OH-+-R ii
H2O2+2-OH=O2↑+ 2H2O iii
实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如图所示:

①从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是______________。
②分析图中曲线,可推断过氧化氢的最佳加入量为_______________ g/ L; 低于或高于这个值,废水处理效果都下降,原因是____________。
(3) 工业上还可用电解法制取三氧化二镍。①用NaOH溶液调节NiCl2溶液PH至7.5,加入适量硫酸钠后采用情性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。写出ClO- 氧化Ni (OH) 2生成三氧化二镍的离子方程式是______, amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是_________。
②电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol 该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,而获得三氧化二镍固体和0.2mol水,则该结晶水合物的化学式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com