
【题目】加热N2O5时,发生以下两个分解反应:N2O5N2O3+O2 , N2O3N2O+O2 , 在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是( )
A.c(N2O5)=1.44 mol/L
B.c(N2O5)=0.94 mol/L
C.c(N2O)=1.40 mol/L
D.c(N2O)=3.48 mol/L
【答案】B
【解析】解:加热N2O5时,发生以下两个分解反应:N2O5N2O3+O2,N2O3N2O+O2,则
N2O5 | N2O3+ | O2 | N2O3 | N2O+ | O2 | ||
起始 | 4 | 0 | 0 | x | 0 | x | |
转化 | x | x | x | y | y | y | |
平衡 | 4﹣x | x | x | x﹣y | y | x+y | |
化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,
则 ![]() ,解得x=3.06,y=1.44,
,解得x=3.06,y=1.44,
c(N2O5)=4﹣3.06=0.94mol/L,c(N2O)=1.44mol/L,
故选B.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】在一定温度下,某可逆反应aA(s)+bB(g)cC(g)在一密闭的容器中达到平衡,如果t0时,改变某一外界条件,化学反应速率(v)﹣时间(t)图象如图所示.下列说法正确的是( )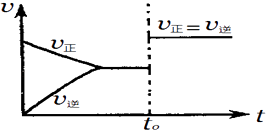
A.若a+b=c,则t0时可能是增大反应体系的压强
B.若a+b=c,则t0时不可能是加入催化剂
C.若a+b≠c,则t0时只可能是加入催化剂
D.若a+b≠c,则t0时有可能是增大反应体系的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
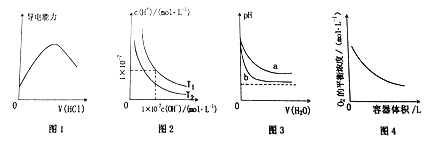
A. 图1表示向氨水中通入HCl气体,溶液的导电能力变化
B. 图2表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1
C. 图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:

(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的元素是________。(填元素符号)
(2)最高价氧化物的水化物中酸性最强的是________,呈两性的是________。
(3)在B、C、E、F中,原子半径最大的是________。
(4)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________。
(5)与C元素同族的第5周期元素X的价电子排布式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用___________(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的______(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_________试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放______溶液(填化学式),反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强电解质溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
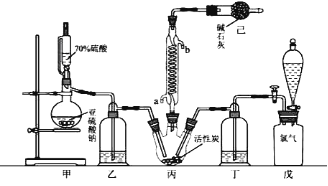
回答下列问题:
(1)装置己的作用是_________________________________________________;如何控制两种反应物体积相等:__________________________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_____(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫会发生副反应,化学方程式是________________________________________________________;同时生成的SO2Cl2也会水解而“发烟”,该反应的化学方程式为______________________________________
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有(填序号)______。
①控制气流速率,宜慢不宜快 ②持续加热丙装置
③若丙装置发烫,可适当降温 ④先通冷凝水,再通气
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分离两种产物的方法是__________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是__________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
请设计实验方案检验产物中存在硫酸(可选试剂:稀盐酸、稀硝酸、氯化钡溶液、蒸馏水、石蕊试液)_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (2﹣羟基﹣4﹣苯基丁酸乙酯)是某药物的中闻体,常温下是一种无色透明的油状液体,沸点为212℃.某同学设计实验制备该物质:原料:
(2﹣羟基﹣4﹣苯基丁酸乙酯)是某药物的中闻体,常温下是一种无色透明的油状液体,沸点为212℃.某同学设计实验制备该物质:原料:  (2﹣羟基﹣4﹣苯基丁酸)和乙醇 实验装置:
(2﹣羟基﹣4﹣苯基丁酸)和乙醇 实验装置:
实验步骤:
①按如图1装置连接仪器.
②20mL 2﹣羟基﹣4﹣苯基丁酸于三颈瓶中,加入适量浓硫酸和20mL无水乙醇,加入几块沸石.
③加热至70℃左右保持恒温半小时.
④分离、提纯三颈瓶中粗产品,得到有机产品.
⑤精制产品.
请回答下列问题:
(1)加入原料时,能否最先加入浓硫酸?(填“能”或“否”).油水分离器的作用是 .
(2)本实验的加热方式宜用(填“直接加热”或“水浴加热”).如果温度过高,或浓硫酸的量过多,制备产率会(填“增大”、“减小”或“不变”).
(3)写出制备反应的化学方程式: .
(4)分离提纯产品:取三颈瓶中混合物加入足量的饱和碳酸钠溶液,分液得到有机层.饱和碳酸钠溶液的作用是 . ①吸收过量的乙醇 ②除去过量的有机酸 ③促进产品水解 ④降低产品在水中溶解度
(5)产品精制:精制产品的实验装置如图2所示,试分析装置是否合理,若不合理将如何改进: . (若装置合理,此空不作答).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com