
【题目】下列图示与对应的叙述相符的是
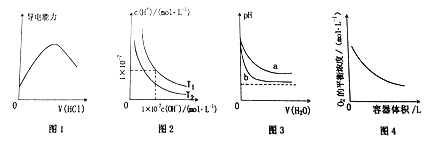
A. 图1表示向氨水中通入HCl气体,溶液的导电能力变化
B. 图2表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1
C. 图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
【答案】C
【解析】向氨水中通入HCl气体,生成氯化铵为强电解质,则溶液的导电能力增强,当氨水完全反应后,继续通HCl,溶液的导电增强,A错误;水的电离过程为吸热过程,升高温度,平衡右移,水电离产生的氢离子和氢氧根离子浓度均增大,所以图中温度T2<T1,B错误;一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释溶液促进弱电解质电离,导致稀释溶液氢氧化钠溶液中氢氧根离子浓度变化较大,氨水中氢氧根离子浓度变化较小,pH变化较小,则a是氨水溶液,C正确;该反应的平衡常数为K=c(O2),当温度不变时,K不变,因此,随着容器体积的增大,相当于减小压强,平衡右移,但是氧气的浓度保持不变,D错误;正确选项C。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2 , 所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p﹣CP,探究有关因素对该降解反应速率的影响. [实验设计]控制p﹣CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表:(表中不要留空格)
实验编号 | 实验目的 | T/K | pH | c/10﹣3 molL﹣1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | 3 | |||
③ | 298 | 10 | 6.0 | 0.30 | |
(2)[数据处理]实验测得p﹣CP的浓度随时间变化的关系如图: 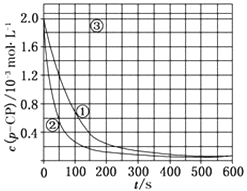
请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p﹣CP)=molL﹣1s﹣1;
(3)[解释与结论] 实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:;
(4)实验③得出的结论是:pH等于10时,反应(填“能”或“不能”)进行;
(5)[思考与交流] 实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的区分方法不正确的是
A.用碘酒区分淀粉溶液与蛋白质溶液
B.用AgNO3溶液区分NaCl与KCl溶液
C.用澄清石灰水区分CO与CO2气体
D.用石蕊试液区分稀H2SO4与NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】功能高分子I的一种合成路线如下,其中D能与Na反应生成H2,且D苯环上的一氯代物有2种。

已知:![]()
回答下列问题:
(1)A的名称为________,试剂a为________。
(2)C的结构简式为________。
(3)F中的官能团名称为________。
(4)上述①~⑧的反应中,不属于取代反应的是________(填数字编号)。写出反应⑦的化学方程式________。
(5)符合下列条件的B的同分异构体有________种(不考虑立体异构)。
①苯环上有氨基(—NH2) ②能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的结构简式为________。
(6)参照上述合成路线,以1-丁烯为原料(无机试剂任选),设计制备乳酸(![]() )的合成路线________。
)的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象和结论都正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 常温下,质量和形状相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 某食盐溶液中加入淀粉溶液 | 溶液不变蓝 | 该食盐样品中一定不含KIO3 |
C | SO2通入BaCl2 溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
D | 将少量大理石粉未加入1.0mol/L的NH4Cl 溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热。下列是一些化学键的键能。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol | 414 | 489 | 565 | 155 |
根据键能数据估算反应CH4+4F2=CF4+4HF每消耗1mol CH4的热效应( )
A. 放热1940 kJ B. 吸热1940 kJ C. 放热485 kJ D. 吸热485 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A+、B-、C2-、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示)。
(2)B的单质可用来制“84”消毒液的主要成分,写出反应的离子方程式_____________。
(3)用文字描述比较B、C两元素的非金属性强弱的方法(必要时可用方程式,至少一条):________________。
(4)D是由两种元素组成的双原子分子,用电子式表示其形成过程___________________。
(5)E是所有含18个电子的微粒中氧化能力最强的分子,其与水反应的化学方程式为________。
(6)F分子中含有4个原子,既有极性键又有非极性键,其电子式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个分解反应:N2O5N2O3+O2 , N2O3N2O+O2 , 在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是( )
A.c(N2O5)=1.44 mol/L
B.c(N2O5)=0.94 mol/L
C.c(N2O)=1.40 mol/L
D.c(N2O)=3.48 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯和苯属于不同类型的有机化合物,但它们之间也有共性。下列关于它们之间共同特点的说法正确的有
A. 都由C和H两种元素组成 B. 都能使酸性KMnO4溶液褪色
C. 都能发生加成反应和取代反应 D. 在氧气中完全燃烧后都生成CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com