
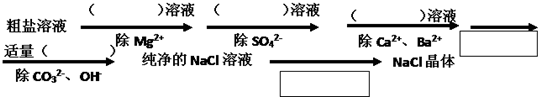


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
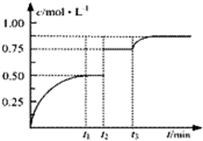 一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A、t1~t3间该反应的平衡常数均为4 |
| B、反应方程式中的x=1 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量物质D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若W元素最高价氧化物对应的水化物为强碱,则X元素最高价氧化物对应的水化物不一定为强碱 |
| B、Y的氢化物比Z的氢化物更稳定 |
| C、原子序数:Z>X>Y>W |
| D、离子半径:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:
 存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.
存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某溶液中加入盐酸,产生CO2气体 | 说明原溶液中一定为Na2CO3 |
| B | 向某溶液中滴入氢氧化钠溶液,产生蓝色沉淀 | 说明原溶液中一定含有Cu2+ |
| C | 向某溶液中滴入氯化钡溶液,产生白色沉淀 | 说明原溶液中一定含有Ag+ |
| D | 向某溶液中先滴入盐酸,再滴入氯化钡溶液,产生白色沉淀 | 说明原溶液中一定含有SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
时间 (s) c(mol?L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.10 | C | d | e |
| c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
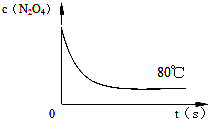
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com