
时间 (s) c(mol?L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.10 | C | d | e |
| c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
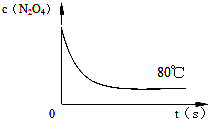
| 0.28mol |
| 2L |
| ||
| 20s |
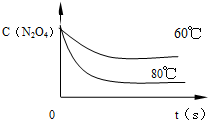
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
| 0.222 |
| 0.09 |
| c2(NO2) |
| c(N2O4) |
 ;
;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C4H10 |
| B、C3H8 |
| C、C3H8O |
| D、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 平衡密闭容器中,加入一定量的X和Y,发生如下反应:2X(?)+Y(?)?2Z(?),不同温度时产物Z的生成情况如图所示:a为T1℃时的情况,b为T2℃时的情况,c为T2℃时从时间t3开始向容器中加压的情况.下列叙述正确的是( )
平衡密闭容器中,加入一定量的X和Y,发生如下反应:2X(?)+Y(?)?2Z(?),不同温度时产物Z的生成情况如图所示:a为T1℃时的情况,b为T2℃时的情况,c为T2℃时从时间t3开始向容器中加压的情况.下列叙述正确的是( )| A、X、Y、Z均为气体,正反应放热 |
| B、Y、Z为气体,X为非气体,正反应放热 |
| C、Z为气体,X、Y中至少有一种为非气体,正反应放热 |
| D、t4时刻气体的平均相对分子质量可能小于t3时刻气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙
乙| A、绝热下向甲中通入惰性气体,c的物质的量不变 |
| B、绝热下向乙中通入z气体,反应器中温度升高 |
| C、恒温下向甲中通入惰性气体,甲中平衡不移动,乙中X、Y的转化率增大 |
| D、恒温下向乙中通入z气体,y的物质的量浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态 |
| B、增大压强,可提高CO2和H2的转化率 |
| C、当平衡向正反应方向移动时,平衡常数一定增大 |
| D、移去生成的乙醇和水,可以加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 目的 | 实验室 制备乙烯 | 分离苯和溴苯的混合物(沸点:苯为80.1℃,溴苯为156.2℃) | 分离KCl和NH4Cl固体混合物 | 实验室用纯碱和稀硫酸制备二氧化碳 |
| 实验装置 |  |  | 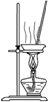 | 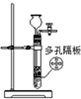 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第2、3周期两元素相差均为8 |
| B、第3、4周期两元素相差均为18 |
| C、第5、6周期两元素相差均为32 |
| D、以上叙述均正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com