
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
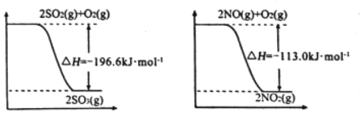
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式:________________;
(2)向容积为1 L的密闭容器中分别充入0.1 mol NO2和0.15 mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示:
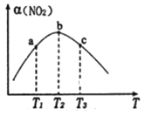
①a、c两点反应速率大小关系:v(a)____v(c)(填“>”“<”或“=”)。若在某温度下达平衡,保持温度、容器的容积不变,再向容器中充入0.2 mol NO2(g)和0.3 mol SO2,NO2的转化率___________(填“增大”“减小”或“不变”);
②在温度小于T2时,NO2的转化率随温度升高而增大的原因是_________;
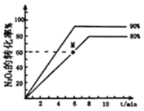
(3)己知可逆反应,N2O4(g)![]() 2NO2(g),v正=k正c(N2O4),v逆=k逆c2(NO2) (k正、k逆只是温度的函数)。向1 L体积固定的密闭容器中充入1 mol N2O4气体分别在T1、T2 (T1>T2)温度下进行该反应。N2O4的转化率与温度、时间的关系如图所示,T1时,该反应的△H____________0(填“>”“<”或“=”),计算M点v正:v逆=_________ (保留到小数点后1位)。
2NO2(g),v正=k正c(N2O4),v逆=k逆c2(NO2) (k正、k逆只是温度的函数)。向1 L体积固定的密闭容器中充入1 mol N2O4气体分别在T1、T2 (T1>T2)温度下进行该反应。N2O4的转化率与温度、时间的关系如图所示,T1时,该反应的△H____________0(填“>”“<”或“=”),计算M点v正:v逆=_________ (保留到小数点后1位)。
【答案】SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H=-41.8 kJ/mol < 不变 温度<T2时,反应正向进行,升高温度,反应速率加快,NO2转化率增大 > 46.1
SO3(g)+NO(g) △H=-41.8 kJ/mol < 不变 温度<T2时,反应正向进行,升高温度,反应速率加快,NO2转化率增大 > 46.1
【解析】
(1)根据图示可得①2SO2(g)+O2(g)![]() 2SO3(g);△H=-196.6 kJ/mol;
2SO3(g);△H=-196.6 kJ/mol;
②O2(g)+2NO(g)=2NO2(g);△H=-113.0 kJ/mol
根据盖斯定律(①②)÷2,整理可得SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H=-41.8 kJ/mol;
SO3(g)+NO(g) △H=-41.8 kJ/mol;
(2)①尽管a点比c点反应物的浓度大,但反应温度c点比a点高,温度对化学反应速率的影响大于浓度对化学反应速率的影响,反应温度越高,化学反应速率越快,所以a、c两点反应速率大小关系:v(a)<v(c);在反应开始时,向容积为1 L的密闭容器中分别充入0.1 mol NO2和0.15 mol SO2,发生反应:SO2(g)+NO2(g)![]() SO3(g)+NO(g),在某温度下达平衡,保持温度、容器的容积不变,再向容器中充入0.2 mol NO2(g)和0.3 mol SO2,由于该反应是反应前后气体体积不变的反应,加入的反应物的物质的量的比相同,增大压强,化学平衡不移动,所以反应NO2的转化率不变;
SO3(g)+NO(g),在某温度下达平衡,保持温度、容器的容积不变,再向容器中充入0.2 mol NO2(g)和0.3 mol SO2,由于该反应是反应前后气体体积不变的反应,加入的反应物的物质的量的比相同,增大压强,化学平衡不移动,所以反应NO2的转化率不变;
②根据图示可知:反应在温度为T2的b点为平衡点,T2以前反应未达到平衡状态,反应正向进行,温度升高,反应速率加快,有更多反应物发生反应转化为生成物,反应物转化率提高;
(3)由于T1>T2,升高温度,化学反应速率加快,且升高温度化学平衡向吸热反应方向移动。根据图示可知在温度为T1时N2O4的转化率较大,说明该反应的正反应为吸热反应,所以△H>0;对于可逆反应,N2O4(g)![]() 2NO2(g) ,反应开始时c(N2O4)=1 mol/L,c(NO2)=0,根据图象可知,在该温度下,平衡时N2O4的转化率为80%,所以平衡时,c(N2O4)=0.2 mol/L,c(NO2)=0.8 mol/L×2=1.6 mol/L,达到平衡时v正= v逆,则k正c(N2O4)=k逆c2(NO2),
2NO2(g) ,反应开始时c(N2O4)=1 mol/L,c(NO2)=0,根据图象可知,在该温度下,平衡时N2O4的转化率为80%,所以平衡时,c(N2O4)=0.2 mol/L,c(NO2)=0.8 mol/L×2=1.6 mol/L,达到平衡时v正= v逆,则k正c(N2O4)=k逆c2(NO2),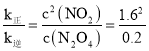 =12.8,在M点时N2O4的转化率为60%,此时c(N2O4)=0.4 mol/L,c(NO2)=0.6 mol/L×2=1.2 mol/L,所以v正:v逆=
=12.8,在M点时N2O4的转化率为60%,此时c(N2O4)=0.4 mol/L,c(NO2)=0.6 mol/L×2=1.2 mol/L,所以v正:v逆= =46.08≈46.1。
=46.08≈46.1。


科目:高中化学 来源: 题型:
【题目】乙醇俗称酒精,在生活中使用广泛。
资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而—OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
(1)乙醇的结构及性质
①1mol乙醇分子中的极性共价键有___________mol。
②从结构角度解释乙醇的沸点比乙烷高的原因____________________ 。
(2)乙醇的用途
①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是________________(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 ______________ 。
(3)乙醇的工业制取
乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。
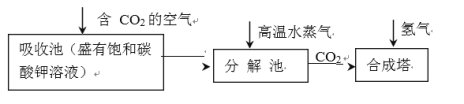
该流程中能循环使用的物质是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如图:

(1)第①步加稀H2SO4时,粗MnO2样品中的__(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是_Mn2++_ClO3-+_H2O=_MnO2↓+_Cl2↑+_H+。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、__、__,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有__(写化学式)
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要__molNaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是4种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知A的一种核素可表示为![]() ,该核素中有10个中子,简单离子B+与Ne原子的核外电子排布相同,C的单质是一种常见的半导体材料,D的最高价氧化物对应水化物的分子式为HDO4。下列说法不正确的是( )
,该核素中有10个中子,简单离子B+与Ne原子的核外电子排布相同,C的单质是一种常见的半导体材料,D的最高价氧化物对应水化物的分子式为HDO4。下列说法不正确的是( )

A.B的简单离子半径小于D的简单离子半径
B.气态氢化物的稳定性:C<D
C.A、B、D元素组成的某种化合物能用于杀菌消毒
D.C的氧化物与B和D的最高价氧化物对应的水化物均能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
A.将 SO2 通入到滴有酚酞的烧碱溶液中红色褪去
B.AgNO3 溶液滴入氯水中产生白色沉淀,随后淡黄绿色褪去
C.H2C2O4 溶液滴入 KMnO4 酸性溶液中产生气泡,随后紫色褪去
D.NO 遇空气变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量可以用来衡量一个国家的石油化工发展水平。B是一种密度比水小的油状液体,B仅由碳、氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式为______________,A的结构式为__________________。
(2)与A分子组成相差一个CH2原子团的A的同系物C与溴的四氯化碳溶液反应的化学方程式为_______________________,反应类型为_______________。
(3)在碘水中加入B振荡静置后的现象是_________________。
(4)B与浓硫酸、浓硝酸在50~60℃下反应的化学方程式为_____________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一个小烧杯里加入研细的20g Ba(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌。

(1)实验中要用玻璃棒搅拌的原因是________________;
(2)写出有关反应的化学方程式:________________,该反应__________(填“是”或“不是”)氧化还原反应。
(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有_________________________。
(4)通过最后一个现象可以说明该反应为_________(填“吸”或“放”)热反应,这是由于反应物的总能量_________(填“大于”或“小于”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com