
【题目】乙醇俗称酒精,在生活中使用广泛。
资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而—OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
(1)乙醇的结构及性质
①1mol乙醇分子中的极性共价键有___________mol。
②从结构角度解释乙醇的沸点比乙烷高的原因____________________ 。
(2)乙醇的用途
①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是________________(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 ______________ 。
(3)乙醇的工业制取
乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。
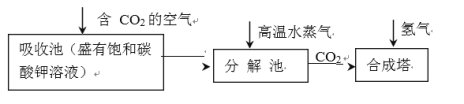
该流程中能循环使用的物质是_________________________。
【答案】7 乙醇分子中含有羟基,分子之间能形成氢键 ab 增大反应物的接触几率或接触面积 K2CO3或碳酸钾
【解析】
(1)①乙醇分子的结构式为: ,分子中含有7个极性共价键,因此1mol乙醇,含有7mol极性键;
,分子中含有7个极性共价键,因此1mol乙醇,含有7mol极性键;
②乙醇的分子中含有羟基,因此乙醇分子之间可以形成氢键,所以沸点比乙烷高;
(2)①a.糖化的过程即淀粉转变为葡萄糖的过程,发酵的过程即葡萄糖转变为乙醇的过程,因此均含有化学变化,a项正确;
b.医用酒精可采用蒸馏的方法分离提纯,b项正确;
c.浓度75%的酒精杀菌消毒效果最好,c项错误;
答案选ab;
②油脂皂化即油脂在碱性条件下的水解反应,由于油脂与NaOH水溶液不互溶,所以二者混合不充分会导致反应速率较慢,若加入乙醇,则可利用乙醇亲水又亲油的结构特点,使二者混合更充分,进而提高反应速率;
(3)向吸收池中通入含CO2的空气后,会使吸收池中的K2CO3转化为KHCO3;向分解池中通高温水蒸气,将CO2提取出的同时,也使得KHCO3又转化为K2CO3;随后CO2在合成塔中与H2反应生成乙醇;综上所述,K2CO3在流程中再生,因此可以循环利用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.4mol充入4L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
t/min | 2 | 4 | 10 | 15 |
n(Y)/mol | 0.32 | 0.28 | 0.20 | 0.20 |
A.反应前4min平均速率v(X)=7.510-3mol·L-1·min-1
B.该温度下此反应的平衡常数:K=20
C.其他条件不变,降低温度,反应达到新平衡前:v(逆)<v(正)
D.保持其他条件不变,起始时向容器中充入0.8mol气体X和0.8mol气体Y,到达平衡时,Y的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___。
(2)写出天然橡胶单体(2—甲基—1,3—丁二烯)的结构简式___。
(3)立方烷![]() 的一氯代物有___种,它的六氯代物有___种。
的一氯代物有___种,它的六氯代物有___种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___。
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是____;互为同分异构体的是____;属于同种物质的是___。
①H2O和D2O②1H、2H、3H③乙烯和环丙烷(C3H6)④![]() 与
与![]() ⑤
⑤![]() 与
与![]() ⑥戊烯和环戊烷⑦
⑥戊烯和环戊烷⑦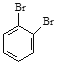 和
和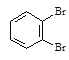
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中性有机物C10H20O2在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得到M,则该中性有机物的结构可能有 ( )
A. 2种B. 3种C. 4种D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种安全性很高的水处理剂,其合成的部分流程如下。
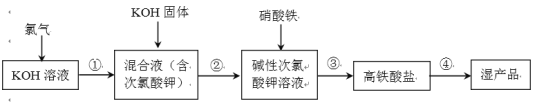
资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2,且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO![]() 2KCl+O2。
2KCl+O2。
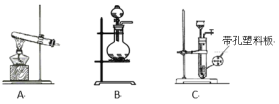
(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的_______。
(2)写出步骤①的离子反应方程式_________________________________ 。
(3)加入KOH固体是为了过滤除盐,过滤除去的是__________________________________。
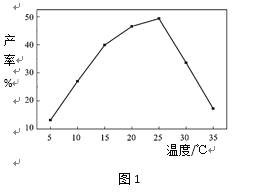
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因:________________ 。
(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:
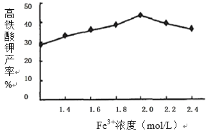
当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:_________________________________________。
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.常温常压下,22gCO2中所含二氧化碳分子数约为6.02×1023
B.0.1molL-1NaOH溶液中含有0.1molNa+
C.0.5molCl2中含有的氯原子数约为6.02×1023
D.标准状况下,44.8L水的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
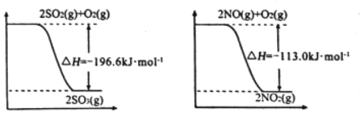
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式:________________;
(2)向容积为1 L的密闭容器中分别充入0.1 mol NO2和0.15 mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示:
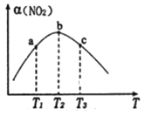
①a、c两点反应速率大小关系:v(a)____v(c)(填“>”“<”或“=”)。若在某温度下达平衡,保持温度、容器的容积不变,再向容器中充入0.2 mol NO2(g)和0.3 mol SO2,NO2的转化率___________(填“增大”“减小”或“不变”);
②在温度小于T2时,NO2的转化率随温度升高而增大的原因是_________;
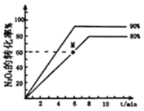
(3)己知可逆反应,N2O4(g)![]() 2NO2(g),v正=k正c(N2O4),v逆=k逆c2(NO2) (k正、k逆只是温度的函数)。向1 L体积固定的密闭容器中充入1 mol N2O4气体分别在T1、T2 (T1>T2)温度下进行该反应。N2O4的转化率与温度、时间的关系如图所示,T1时,该反应的△H____________0(填“>”“<”或“=”),计算M点v正:v逆=_________ (保留到小数点后1位)。
2NO2(g),v正=k正c(N2O4),v逆=k逆c2(NO2) (k正、k逆只是温度的函数)。向1 L体积固定的密闭容器中充入1 mol N2O4气体分别在T1、T2 (T1>T2)温度下进行该反应。N2O4的转化率与温度、时间的关系如图所示,T1时,该反应的△H____________0(填“>”“<”或“=”),计算M点v正:v逆=_________ (保留到小数点后1位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com