
【题目】在一定温度下,将气体X和气体Y各0.4mol充入4L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
t/min | 2 | 4 | 10 | 15 |
n(Y)/mol | 0.32 | 0.28 | 0.20 | 0.20 |
A.反应前4min平均速率v(X)=7.510-3mol·L-1·min-1
B.该温度下此反应的平衡常数:K=20
C.其他条件不变,降低温度,反应达到新平衡前:v(逆)<v(正)
D.保持其他条件不变,起始时向容器中充入0.8mol气体X和0.8mol气体Y,到达平衡时,Y的转化率为50%
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种结构,六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,有白色石墨之称,具有电绝缘性,可作高温润滑剂。立方相氮化硼是超硬材料,硬度可媲美钻石,常被用作磨料和刀具材料。它们的晶体结构如图所示,关于两种晶体的说法,错误的是
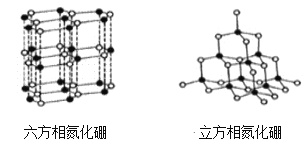
A. 六方相氮化硼属于混合晶体,其层间是靠范德华力维系,所以质地软
B. 立方相氮化硼含有σ键和π键,所以硬度大
C. 六方氮化硼不能导电是因为其层结构中没有自由电子
D. 相同质量的六方相氮化硼和立方相氮化硼所含共价键数不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究SO2与Fe3+盐溶液的反应,进行了如下实验:已知:Fe3++HSO3-Fe(HSO3)2+(红棕色)
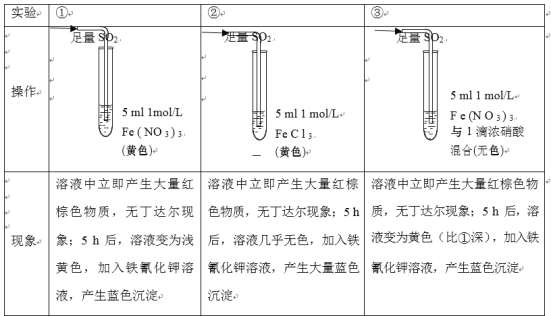
结合上述实验,下列说法不正确的是
A.产生红棕色物质的反应速率快于SO2与Fe3+氧化还原反应的速率
B.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响
C.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,说明浓硝酸具有漂白性
D.5h后③比①黄色更深不能证明是NO3-浓度的增大减慢了SO2与Fe3+反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇俗称酒精,在生活中使用广泛。
资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而—OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
(1)乙醇的结构及性质
①1mol乙醇分子中的极性共价键有___________mol。
②从结构角度解释乙醇的沸点比乙烷高的原因____________________ 。
(2)乙醇的用途
①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是________________(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 ______________ 。
(3)乙醇的工业制取
乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。
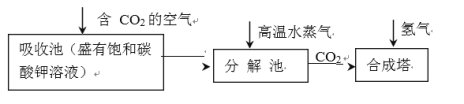
该流程中能循环使用的物质是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120 ℃以上发生分解。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图所示)加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
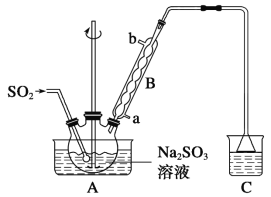
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶,抽滤。
(1)仪器B的名称为__________,装置A中通入SO2的导管末端是多孔球泡,其作用是:__________________________________________。
(2)装置C的作用是________________。
(3)①步骤2中,应采用何种加热方式____________,优点是________________;
②冷凝管中回流的主要物质除H2O外还有__________(填化学式)。
(4)步骤3中不在敞口容器中蒸发浓缩的原因是_____________________________。
(5)请写出步骤1中制取NaHSO3的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是4种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知A的一种核素可表示为![]() ,该核素中有10个中子,简单离子B+与Ne原子的核外电子排布相同,C的单质是一种常见的半导体材料,D的最高价氧化物对应水化物的分子式为HDO4。下列说法不正确的是( )
,该核素中有10个中子,简单离子B+与Ne原子的核外电子排布相同,C的单质是一种常见的半导体材料,D的最高价氧化物对应水化物的分子式为HDO4。下列说法不正确的是( )

A.B的简单离子半径小于D的简单离子半径
B.气态氢化物的稳定性:C<D
C.A、B、D元素组成的某种化合物能用于杀菌消毒
D.C的氧化物与B和D的最高价氧化物对应的水化物均能反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com