
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120 ℃以上发生分解。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图所示)加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
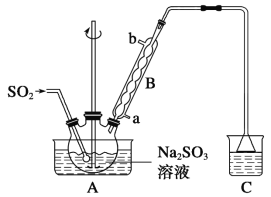
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶,抽滤。
(1)仪器B的名称为__________,装置A中通入SO2的导管末端是多孔球泡,其作用是:__________________________________________。
(2)装置C的作用是________________。
(3)①步骤2中,应采用何种加热方式____________,优点是________________;
②冷凝管中回流的主要物质除H2O外还有__________(填化学式)。
(4)步骤3中不在敞口容器中蒸发浓缩的原因是_____________________________。
(5)请写出步骤1中制取NaHSO3的化学方程式:_____________________________。
【答案】(球形)冷凝管 增大接触面积使SO2充分反应 吸收二氧化硫并防止倒吸 水浴加热 均匀受热、容易控制温度 HCHO 防止产物被空气氧化 Na2SO3+SO2+H2O=2NaHSO3
【解析】
(1)装置A中通入SO2的导管末端是多孔球泡,可增大二氧化硫气体和Na2SO3液体的接触面积;
(2)装置C是尾气吸收装置,结合二氧化硫易溶于水分析解答;
(3)次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O) 在120 ℃以上发生分解;HCHO易挥发据此分析解答;
(4)根据化合价分析次硫酸氢钠甲醛具有的性质,结合次硫酸氢钠甲醛的性质分析判断;
(5)步骤1中Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液,据此书写反应的化学方程式。
(1)根据装置图,仪器B为(球形)冷凝管,装置A中通入SO2的导管末端是多孔球泡,可增大二氧化硫气体和Na2SO3液体的接触面积,加快反应速度,故答案为:(球形)冷凝管;增大接触面积使SO2充分反应,加快反应速度;
(2)装置C是尾气吸收装置,倒置的漏斗可以防倒吸,所以装置C的作用是吸收未反应的二氧化硫,防止污染空气并阻止空气进入装置A,故答案为:吸收二氧化硫并防止倒吸;
(3)①次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O) 在120 ℃以上发生分解,根据分解温度应选择水浴加热,而且水浴加热均匀,容易控制温度,故答案为:水浴加热;均匀受热、容易控制温度;
②HCHO易挥发,在80°C-90°C条件下会大量挥发,加冷凝管可以使HCHO冷凝回流提高HCHO的利用率,故答案为:HCHO;
(4)次硫酸氢钠甲醛具有还原性,在敞口容器中蒸发浓缩,次硫酸氢钠甲醛可以被空气中的氧气氧化变质,故答案为:防止产物被空气氧化;
(5)步骤1中Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液,反应的化学方程式为Na2SO3+SO2+H2O===2 NaHSO3,故答案为:Na2SO3+SO2+H2O=2NaHSO3。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,某恒容容器中发生可逆反应3H2(g)+N2(g) ![]() 2NH3 (g) ,下列叙述中能说明反应已达平衡状态的是
2NH3 (g) ,下列叙述中能说明反应已达平衡状态的是
A. 反应混合气体的质量不再变化B. 某一时刻测得![]()
C. 反应容器内气体体积不再变化D. 当生成0.3 mol H2的同时消耗了0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.4mol充入4L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
t/min | 2 | 4 | 10 | 15 |
n(Y)/mol | 0.32 | 0.28 | 0.20 | 0.20 |
A.反应前4min平均速率v(X)=7.510-3mol·L-1·min-1
B.该温度下此反应的平衡常数:K=20
C.其他条件不变,降低温度,反应达到新平衡前:v(逆)<v(正)
D.保持其他条件不变,起始时向容器中充入0.8mol气体X和0.8mol气体Y,到达平衡时,Y的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中性有机物C10H20O2在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得到M,则该中性有机物的结构可能有 ( )
A. 2种B. 3种C. 4种D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种安全性很高的水处理剂,其合成的部分流程如下。
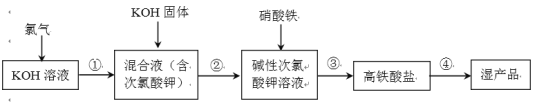
资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2,且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO![]() 2KCl+O2。
2KCl+O2。
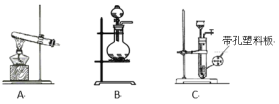
(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的_______。
(2)写出步骤①的离子反应方程式_________________________________ 。
(3)加入KOH固体是为了过滤除盐,过滤除去的是__________________________________。
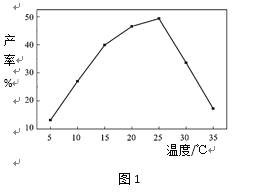
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因:________________ 。
(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:
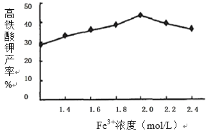
当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:_________________________________________。
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关氨气的叙述中不正确的是( )
A.潮湿的氨气可以用浓硫酸干燥
B.氨的喷泉实验体现了氨的溶解性
C.氨具有还原性,一定条件下可与氧气发生反应
D.实验室里可用氨水与生石灰制取少量氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.常温常压下,22gCO2中所含二氧化碳分子数约为6.02×1023
B.0.1molL-1NaOH溶液中含有0.1molNa+
C.0.5molCl2中含有的氯原子数约为6.02×1023
D.标准状况下,44.8L水的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将agFe2O3、Al2O3的混合固体溶解在200mL0.1mol/L的过量硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为()
A.0.1mol/LB.0.2mol/LC.0.4mol/LD.0.8mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com