
【题目】以下有关氨气的叙述中不正确的是( )
A.潮湿的氨气可以用浓硫酸干燥
B.氨的喷泉实验体现了氨的溶解性
C.氨具有还原性,一定条件下可与氧气发生反应
D.实验室里可用氨水与生石灰制取少量氨气
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中氮的氧化物NO、NO2被氢氧化钠溶液吸收的主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O,现有aL(标准状况)NO和NO2混合气体被足量氢氧化钠溶液吸收,没有气体残余,下列说法不正确的是 ( )
A.实际参加反应的氢氧化钠的物质的量是a/22.4 mol
B.混合气体气体中NO2体积一定大于(等于)NO体积
C.溶液中NaNO3物质的量一定小于(等于)NaNO2物质的量
D.若生成的NaNO2与NaNO3的物质的量之比为3:1,则混合气体中NO与NO2的体积比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究SO2与Fe3+盐溶液的反应,进行了如下实验:已知:Fe3++HSO3-Fe(HSO3)2+(红棕色)
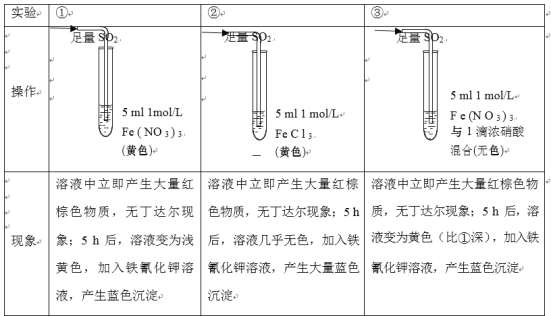
结合上述实验,下列说法不正确的是
A.产生红棕色物质的反应速率快于SO2与Fe3+氧化还原反应的速率
B.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响
C.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,说明浓硝酸具有漂白性
D.5h后③比①黄色更深不能证明是NO3-浓度的增大减慢了SO2与Fe3+反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是一种化工原料,其合成路线如下:
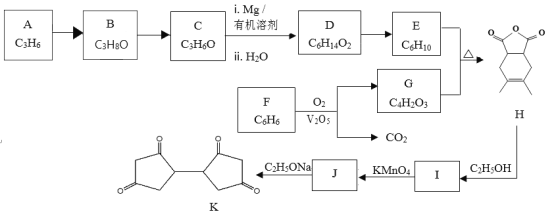
已知:i: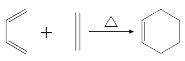
ii: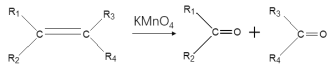
iii: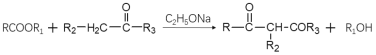 (R1为烃基)
(R1为烃基)
(1)按照官能团分类,A的类别是_______________________。
(2)C分子中只有一种类型的氢原子,B→C的化学方程式是_____________________。
(3)已知D的核磁共振氢谱有2个峰,1molD与足量Na反应可生成1molH2,写出D→E的化学方程式是 ___________________________ 。
(4)G的结构简式是___________________________。
(5)由F制备G,产物G与CO2物质的量之比为___________________________。
(6)M是G的同分异构体,写出符合下列条件的M的结构简式_________________。
a.能与NaHCO3反应产生气泡
b.能发生银镜反应
(7)写出结构简式:I _____________、J _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120 ℃以上发生分解。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图所示)加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
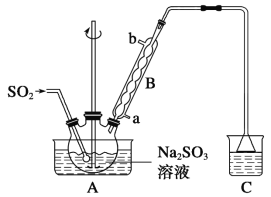
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶,抽滤。
(1)仪器B的名称为__________,装置A中通入SO2的导管末端是多孔球泡,其作用是:__________________________________________。
(2)装置C的作用是________________。
(3)①步骤2中,应采用何种加热方式____________,优点是________________;
②冷凝管中回流的主要物质除H2O外还有__________(填化学式)。
(4)步骤3中不在敞口容器中蒸发浓缩的原因是_____________________________。
(5)请写出步骤1中制取NaHSO3的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氧化铜与稀硫酸反应:CuO+4H++SO![]() =Cu2++SO2↑+2H2O
=Cu2++SO2↑+2H2O
B.二氧化碳通入足量澄清石灰水中:Ca2++2OH-+CO2=CaCO3↓+H2O
C.铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.氢氧化钡溶液与硫酸反应:OH-+H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A.测定一定质量的Cu和Mg混合物中Cu的含量
B.确定分子式为C2H6O的有机物分子中含活泼氢原子的个数
C.比较Fe3+和Cu2+对一定质量的双氧水分解反应的催化效率
D.测定一定质量的Na2SO4·xH2O晶体中结晶水数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是____(填元素名称),写出⑧的原子结构示意图______。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是___。
(3)①与⑤形成的化合物中,化学键类型为_____。
(4)⑦与⑨形成的化合物的电子式为___,②与④形成的原子个数比为1:2的化合物的结构式为____。
(5)③、④、⑥的原子半径由大到小的顺序为_____(用元素符号回答)。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
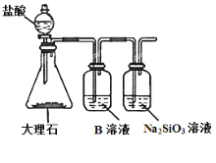
a.溶液B的作用是_______
b.若看到____现象,即可证明酸性_______(用化学式回答),则非金属性_______(用元素符号回答)。
c.上述实验中,能说明②和⑧非金属性强弱的化学方程式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com