
| A、-(5X-0.5Y)kJ/mol |
| B、-Y kJ/mol |
| C、-(10X-Y)kJ/mol |
| D、+(10X-Y)kJ/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 | ||
| B、相同温度下,水的离子积常数就是水的电离平衡常数 | ||
C、由K水解=
| ||
| D、同温同浓度条件下,一元弱酸的电离平衡常数(K)越小,则溶液的pH越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
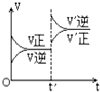 对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )
对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )| A、X、Y、W为气体,Z不是气体 |
| B、X、Y为气体,W、Z中有一种是气体 |
| C、W、Z为气体,X、Y中有一种是气体 |
| D、W、Z中有一种为气体,X、Y都不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水,浓H2SO4 |
| B、KMnO4酸性溶液,浓H2SO4 |
| C、溴水,烧碱溶液,浓硫酸 |
| D、NaOH溶液,浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液显碱性 |
| C、该NaCl溶液中KW=c(H+)?c(OH-)=1×10-14 |
| D、该NaCl溶液中KW=c(H+)?c(OH-)=1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2 | H2 | NH3 | |
| ′起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末mol/L | 0.6 | 1.8 | 0.8 |
| A、0.2 | B、0.4 |
| C、0.6 | D、0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中必须含有金属阳离子 |
| B、物质中化学键被破坏,则一定发生化学变化 |
| C、NaCl的结构式为Na-Cl |
| D、H2O的沸点高于H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com