
| 溴化铁 |
| 溴化铁 |
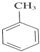 +3HNO3
+3HNO3| 浓硫酸 |
| △ |
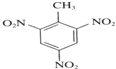 +3H2O,
+3H2O, +3HNO3
+3HNO3| 浓硫酸 |
| △ |
 +3H2O.
+3H2O.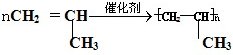 ,
,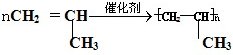 ;
;| 加热 |
| 加热 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、-(5X-0.5Y)kJ/mol |
| B、-Y kJ/mol |
| C、-(10X-Y)kJ/mol |
| D、+(10X-Y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
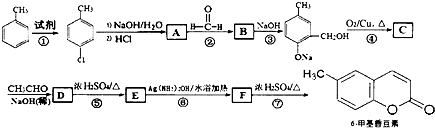
| NaOH(稀) |
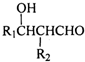 ,其中R1和R2为(烃基或H).请回答下列问题:
,其中R1和R2为(烃基或H).请回答下列问题: 结构且苯环上有2种化学环境的氢原子
结构且苯环上有2种化学环境的氢原子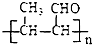 )请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO
)请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
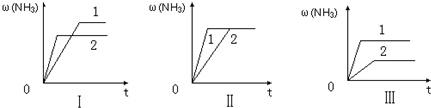
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com