
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 、
、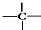 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如: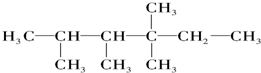 分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.
分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、K、Ca |
| B、N、P、S |
| C、F、Cl、S |
| D、O、S、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若正反应是吸热反应,则A为非气态 |
| B、若正反应是放热反应,则A为气态 |
| C、若在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D、压强对该平衡的移动无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com