
 、
、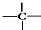 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如: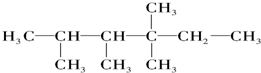 分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.
分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
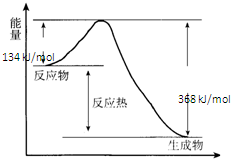 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在多电子的原子里,能量高的电子通常在离核近的区域内活动 |
| B、任何元素的原子都是由核外电子和核内中子、质子组成的 |
| C、40 18Ar、40 19K、40 20Ca的质量数相同,所以它们是互为同位素 |
| D、核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
| B、1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
| C、S(s)+O2(g)?SO2(g)△H<-Q kJ?mol-1 |
| D、1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B和C的摩尔质量比为3:1:4 |
| B、生成物C中A的质量分数为75% |
| C、生成物C中A、B的原子个数比为3:1 |
| D、反应前后气体分子数比为1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com